
【題目】原子中質子、中子、電子的數量、質量和電性之間存在一定的相互關系。請填寫下列空白:
(1)質子數決定________的種類;質子數和中子數決定________的種類。
(2)![]() 代表一個質量數為________、質子數為______、中子數為________、核外電子數為________的原子。
代表一個質量數為________、質子數為______、中子數為________、核外電子數為________的原子。
(3)質量數=________+________,對任一原子,核電荷數=________;對中性原子,核外電子數=________。
(4)ZXn-中核外電子數=________,ZXn+中核外電子數為________。
【答案】元素原子AZA-ZZ質子數中子數質子數質子數Z+n Z-n
【解析】
應依據元素、核素的概念和中性原子、陰陽離子中質子數、中子數、電子數、質量數之間的數目關系分析解答。
(1)不同種原子的質子數不同,元素的種類是由原子的質子數決定的;原子中質量數=質子數+中子數,原子不同質量數不同,即原子的核內質子數和中子數決定原子的種類;
(2) 原子中:質子數(Z)+中子數(N)=質量數(A),![]() 代表一個質量數為A、質子數為Z、中子數為A-Z、核外電子數為Z的原子;
代表一個質量數為A、質子數為Z、中子數為A-Z、核外電子數為Z的原子;
(3)質量數=質子數+中子數,對任一原子,核電荷數=質子數;對中性原子,核外電子數=質子數;
(4)ZXn-中核外電子數=Z+n,ZXn+中核外電子數為Z-n。


科目:高中化學 來源: 題型:
【題目】一氯乙酸(ClCH2-COOH)在有機合成中是一種重要的原料和中間體,在硫單質催化下干燥氯氣與乙酸反應制得一氯乙酸:![]()
![]()
![]()
已知:

請回答下列問題:
(1)選用下圖的裝置制備一氯乙酸粗品。

①按照氣流從左至右依次連接的合理順序為____→____→____→____→____→i→j→g→h(填接口字母)。____
②洗氣瓶中的溶液為____,堿石灰的作用是____。
(2)制備一氯乙酸時,首先采用____(填“水浴”、“油浴”或“沙浴”)加熱方法控制溫度在95℃左右,待溫度穩定后,再打開彈簧夾、____(填操作),如果三頸燒瓶溶液表面觀察到大量 ___(填現象)時,應該___(填操作),以減少氯氣通入量,以免浪費。
(3)一氯乙酸粗品中含有二氯乙酸、三氯乙酸,多次蒸餾后產品中仍含有少量的____(填物質名稱),再進行____(填“過濾”、“分液”或“重結晶”),可得到純凈的一氯乙酸。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH3—O2堿性燃料電池的示意圖如下,有關說法正確的是

A. a極每產生1molN2,約有6×6.02×1023個OH-遷移至b極
B. a極的電極反應為:2NH3 -6e- = N2+ 6H+
C. b極的電極反應為:4OH- -4e- = 2H2O + O2↑
D. 該電池總反應為:4NH3 + 3O2 = 2N2 + 6H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2二溴乙烷可作汽油抗爆劑的添加劑,常溫下它是無色液體,沸點131.4℃,熔點9.79℃,不溶于水,易溶于醇、醚、丙酮等有機溶劑。在實驗中可以用圖9所示裝置制備1,2二溴乙烷。其中分液漏斗和燒瓶a中裝有乙醇和濃硫酸的混合液,試管d中裝有液溴(表面覆蓋少量水)。請填寫下列空白:

(1)燒瓶a要求溫度迅速升高到170℃發生反應,寫出該反應的化學方程式 ;該反應類型為 。
(2)寫出制備1,2二溴乙烷的化學方程式 。
(3)安全瓶b可以防止倒吸,并可以檢查實驗進行時試管d是否發生堵塞。請寫出發生堵塞時瓶b中的現象 。
(4)容器c中NaOH溶液的作用是 ;e裝置內NaOH溶液的作用是 。
(5)某學生做此實驗時,使用一定量的液溴,當溴全部褪色時,所消耗乙醇和濃硫酸混合液的量,比正常情況下超出許多,如果裝置的氣密性沒有問題,試分析其可能的原因(至少2點) 、 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳廢料中主要含有Ni,還有少量的Cu、Fe、Pb等。現從中制取Ni2O3,可用于制造人造衛星、宇宙飛船的高能電池,也可用于制成鎳鎘堿性電池。生產流程見下:

已知0.010 mol/L金屬離子在不同pH下的沉淀情況如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
開始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列問題:
(1)加入碳酸鈣調pH的目的是___________________,“沉渣2”的主要成分是_____,必須先過濾“沉渣1”后再進行“除Cu”的原因是______________。
(2)用離子方程式解釋加入NH4F “除Ca”的過程________________。
(3)“酸浸”時參與反應的H2SO4與HNO3物質的量比保持為3:2,此時Ni單質所發生的化學方程式為_______。
(4)“操作X”是________、________
(5)向NiO中加入鹽酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,寫出其中和NaClO相關的反應的離子方程式為__________________。
(6)根據上表數據,計算當0.010 mol/L NiSO4溶液中Ni2+完全沉淀時的c(Ni2+)= ____mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏伽德羅常數的數值,下列敘述錯誤的是( )
A.標準狀況下,11.2 L氦氣中含有0.5 NA原子
B.標準狀況下,0.1 mol Cl2參加反應,轉移的電子數目一定為0.2 NA
C.常溫常壓下,18g H2O 所含的中子數為8NA
D.1mol鋁分別和足量的氫氧化鈉溶液和硫酸溶液反應轉移的電子都3mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知SO2+I2+2H2O===H2SO4+2HI,某化學興趣小組選用下列實驗裝置,測定工業原料氣(含SO2、N2、O2)中SO2的含量。

(1)若原料氣從左流向右時,上述裝置組裝連接的順序:原料氣→__________________(填“a”“b”“c”“d”“e”)。
(2)裝置Ⅱ中發生反應的離子方程式為_____________;當裝置Ⅱ中出現________現象時,立即停止通氣。
(3)若碘溶液的濃度為0.05 mol/L、體積為20 mL,收集到的N2與O2的體積為297.6 mL(已折算為標準狀況下的體積),SO2的體積分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈉常用作漂白劑、殺菌劑、消毒劑,能與水和二氧化碳等物質發生反應,保存不當時容易變質。某實驗小組以過氧化鈉為研究對象進行了如下實驗。
(1)探究一包Na2O2樣品是否已經變質:取少量樣品,將其溶解,加入__________溶液,充分振蕩后有白色沉淀,證明Na2O2已經變質。
(2)該實驗小組為了粗略測定過氧化鈉的質量分數,稱取了m g樣品,并設計用如圖裝置來測定過氧化鈉的質量分數。

①裝置中儀器a的名稱是_________,裝置D的作用是________________;
②將儀器連接好以后,必須進行的第一步操作是_____________________;
③寫出裝置C中發生主要反應的化學方程式_______________________;
④反應結束后,在讀取實驗中生成氣體的體積時,你認為合理的是________(填序號);
a.讀取氣體體積前,需冷卻到室溫
b.調整量筒使E、F內液面高度相同
c.視線與凹液面的最低點相平時讀取量筒中水的體積
⑤讀出量筒內水的體積后,將其折算成標準狀況下氧氣的體積為VmL,則樣品中過氧化鈉的質量分數為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解硫酸鈉溶液聯合生產硫酸和燒堿溶液的裝置如圖所示,其中陰極和陽極均為惰性電極.測得同溫同壓下,氣體甲與氣體乙的體積比約為1:2,以下說法正確的是
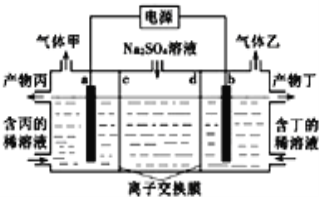
A. 左側a極與電源的負極相連
B. 電解使右側溶液的pH減小
C. 離子交換膜d為陽離子交換膜(允許陽離子通過)
D. 當電路中通過1mol電子時,氣體甲在標準狀況下的體積為11.2L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com