
【題目】硫酸鎂還原熱解制備高純氧化鎂是一種新的探索。以菱鎂礦(主要成分為MgCO3,另含少量雜質FeCO3和SiO2等)為原料制備高純氧化鎂的實驗流程如下:
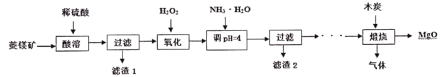
(1)MgCO3與稀硫酸反應的離子方程式是____________。
(2)加入H2O2氧化時,發生反應的離子方程式為____________________。
(3)煅燒過程存在以下反應:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下圖裝置對煅燒產生的氣體進行分步吸收或收集。
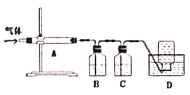
①A中現象是________,A中收集的物質可用熱的NaOH溶液去除,寫出該反應的化學反應方程式:__________________。
②B中盛放的溶液可以是_________(填字母)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.品紅溶液 e.酸性KMnO4溶液
③D中收集的氣體可以是________(填化學式)。
【答案】MgCO3+2H+=Mg2++CO2↑+H2O 2Fe2++2H++H2O2=2Fe3++2H2O A中有淡黃色固體附著 3S +6NaOH =△ Na2SO3+ 2Na2S+3H2O e CO
【解析】
根據流程圖及題干信息分析每步發生的化學反應,進而判斷濾渣、濾液的成分,書寫離子放出式;根據裝置圖及題干信息分析圖中裝置的作用及盛放的試劑。
(1)MgCO3與稀硫酸發生復分解反應生成硫酸鎂、二氧化碳和水,離子方程式是MgCO3+2H+=Mg2++CO2↑+H2O,
故答案為:MgCO3+2H+=Mg2++CO2↑+H2O;
(2)濾液中含有亞鐵離子,加入H2O2氧化時,亞鐵離子被氧化,離子方程式為:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案為: 2Fe2++2H++H2O2=2Fe3++2H2O;
(3)①根據題干信息知煅燒后生成黃色固體S,所以A中現象是有淡黃色固體附著;A中生成的物質有MgO和S,S與NaOH溶液反應的化學反應方程式:3S +6NaOH ![]() Na2SO3+ 2Na2S+3H2O;
Na2SO3+ 2Na2S+3H2O;
②煅燒產生的氣體有二氧化硫、二氧化碳和一氧化碳,若進行分步吸收,則先利用二氧化硫的還原性用酸性高錳酸鉀吸收,所以B中盛放的溶液可以是酸性高錳酸鉀;
③產生氣體中二氧化硫和二氧化碳被吸收,所以D中收集的氣體可以是CO,
故答案為:A中有淡黃色固體附著;3S +6NaOH![]() Na2SO3+ 2Na2S+3H2O;e;CO。
Na2SO3+ 2Na2S+3H2O;e;CO。


科目:高中化學 來源: 題型:
【題目】用NA代表阿伏加德羅常數的值,下列說法正確的是
A. 32.5g鋅粒與足量鹽酸反應產生11.2 L H2
B. 標準狀況下,11.2 L CCl4所含分子數為0.5NA
C. 1mol NaHSO4中含有的陰陽離子的總數目為 3NA
D. 常溫常壓下,40g O2和O3的混合氣體中,含有氧原子的數目為2.5 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,水作還原劑的是
A. 2H2O+2F2=4HF+O2 B. 2Na2O2+2H2O=4NaOH+O2↑
C. 2Na+2H2O=2NaOH+H2↑ D. 2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是
A. 金屬鈉投入到足量的稀鹽酸中: Na+2H+==Na++H2↑
B. CuO溶解在稀鹽酸中:O2-+2H+==H2O
C. 氫氧化鋇溶液與稀硫酸反應:Ba2++SO![]() +H++OH-== BaSO4↓+H2O
+H++OH-== BaSO4↓+H2O
D. 碳酸氫鈣溶液與稀鹽酸反應:HCO![]() +H+==H2O+CO2↑
+H+==H2O+CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸乙酯有四種常見的合成方法。己知A是一種單糖,廣泛存在于帶甜味的水果中,B是一種生活中常見的含氧有機物且式量為46,E是一種石油裂解產物,能做水果的催熟劑。它們之間的轉化關系如下圖:

請回答:
(1)有機物E中含有的官能團名稱是________________ 。
(2)反應④的反應類型是__________________ 。
(3)有機物B在催化劑的作用下可直接轉化為乙酸乙酯和另外一種常見氣體,請寫出該反應的化學方程式___________。
(4)下列說法正確的是___________。
A.有機物A不能使碘水變藍
B.反應⑤是同分異構體之間的相互轉換
C.有機物B、D和乙酸乙酯都是揮發性無色液體,可以通過聞氣味進行鑒別
D.等質量的有機物A、D和乙酸乙酯充分燃燒,消耗氧氣的質量也相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學興趣小組探究SO2與FeCl3溶液的反應,所用裝罝如下圖所示。請回答:

(1)裝置A中分液漏斗內的物質是________________ 。
(2)實驗時,旋開裝置A中分液漏斗的旋塞,發現液體流出緩慢,最終停止,其可能的原因是___________________。
(3)實驗過程中通入足量的SO2,請設計一個實驗方案,驗證SO2與FeCl3溶液反應的主要產物(H+無需檢驗)______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的固定對人類的生存發展具有重要意義,科學家一直致力于“人工固氮”的新方法研究。
(1)豆科植物的根瘤菌含有一種固氮酶,能在常溫下將空氣中的氮氣轉化為自身生長所需的含氮化合物,下列說法錯誤的是________(填標號)。
a.固氮酶是一種蛋白質
b.固氮酶能降低固氮反應發生所需的能量
c.固氮酶能使固氮反應的平衡正向移動
d.固氮酶能加快固氮反應的速率
(2)合成氨是目前最重要的固氮方法。下圖為合成氨反應N2(g)+3H2(g)![]() 2NH3(g)在不同溫度和壓強、使用相同催化劑條件下,初始時氮氣、氫氣的體積之比為1∶3時,平衡混合物中氨的體積分數的變化曲線如下圖。
2NH3(g)在不同溫度和壓強、使用相同催化劑條件下,初始時氮氣、氫氣的體積之比為1∶3時,平衡混合物中氨的體積分數的變化曲線如下圖。
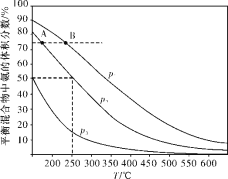
①A、B兩平衡狀態相比較,前者較大的是___________(填標號)。
a.平衡常數 b.平衡混合物的平均摩爾質量
c.氫氣的轉化率 d.從反應開始至達到平衡狀態所需要的時間
②圖中p1、p2、p3由大到小的順序為_____________________。
③在250 ℃、p2下,H2的轉化率為_____________%(結果保留小數點后一位)。
(3)據報道:在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生反應,生成的主要產物為NH3和一種單質。已知:①H2(g)+![]() O2(g)===H2O(l) ΔH1=-285.6 kJ/mol,②N2(g)+3H2(g)
O2(g)===H2O(l) ΔH1=-285.6 kJ/mol,②N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-92.2 kJ/mol,寫出此條件下氮氣和水反應的熱化學方程式:________________。
2NH3(g) ΔH2=-92.2 kJ/mol,寫出此條件下氮氣和水反應的熱化學方程式:________________。
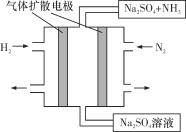
(4)下圖為一種常溫常壓下水溶液中電化學合成氨的實驗裝置示意圖。請據此寫出其正極反應的電極反應式:_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 油脂在堿性條件下水解可生成高級脂肪酸鹽和甘油
B. 淀粉、纖維素和蔗糖都屬于糖類,一定條件下水解都只生成葡萄糖
C. 蛋白質在紫外線、CuSO4溶液、福爾馬林作用下均會發生變性
D. 二氧化碳和環氧丙烷(![]() )在催化劑作用下可生成一種可降解的塑料
)在催化劑作用下可生成一種可降解的塑料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列說法不正確的是
A. 物質的量濃度相同的NaOH溶液和氨水:c(Na+)>c(NH4+)
B. 物質的量濃度相同的鹽酸和醋酸溶液,前者c(OH-)更小
C. 將相同體枳相同物質的量濃度的NaOH溶液和醋酸溶液混合后呈堿性,說明醋酸是弱電解質
D. pH=3的鹽酸和pH=11的氨水混合后pH>7,說明氨水是弱電解質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com