
【題目】工業上常以烴的含氧衍生物X為主要原料生產可降解塑料PCL{![]() }及阻燃劑四溴雙酚A.合成線路如下:
}及阻燃劑四溴雙酚A.合成線路如下:
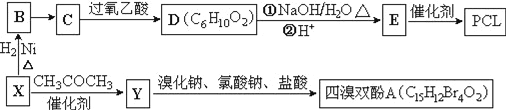
已知:①X的蒸汽密度是相同條件下H2的47倍,遇FeCl3溶液顯紫色;C為![]() 。
。
②![]() 。
。
③RCOCH2R′![]() RCOOCH2R′。
RCOOCH2R′。
(1)B的名稱是_________________。
(2)B→C還需要的反應試劑及條件是___________。C→D的反應類型是______________________。
(3)寫出X→Y的化學方程式:_______________________________。
(4)0.5mol四溴雙酚A在一定條件下與足量的NaOH溶液反應,最多消耗__molNaOH。
(5)符合以下條件的D的同分異構體有__種(不考慮空間異構)。
①含有兩個甲基和兩種官能團 ②能使溴的CCl4溶液褪色 ③能發生銀鏡反應
(6)已知由烯烴直接制備不飽和酯的新方法為:
![]()
利用乙烯為有機原料(無機物和反應條件自選)合成聚合物涂料![]() ,寫出合成該涂料的反應流程圖:________________________________。
,寫出合成該涂料的反應流程圖:________________________________。
【答案】 環己醇 O2、Cu、加熱 氧化反應 ![]() 5 10
5 10 ![]()
【解析】由已知①X的蒸汽密度是相同條件下H2的47倍,則X相對分子質量為94,遇FeCl3溶液顯紫色,說明含有酚羥基,所以X為![]() ;X和氫氣發生加成反應生成B,則B為
;X和氫氣發生加成反應生成B,則B為![]() ;C為
;C為![]() ,則B發生催化氧化生成C,PCL{
,則B發生催化氧化生成C,PCL{![]() }為E發生縮聚反應產物,則E結構簡式為HO(CH2)5COOH,D發生水解反應后酸化得到E,則D結構簡式為
}為E發生縮聚反應產物,則E結構簡式為HO(CH2)5COOH,D發生水解反應后酸化得到E,則D結構簡式為![]() ;由已知②,X(
;由已知②,X(![]() )和丙酮發生取代反應生成Y,則Y的結構簡式為
)和丙酮發生取代反應生成Y,則Y的結構簡式為![]() ,四溴雙酚A結構簡式為
,四溴雙酚A結構簡式為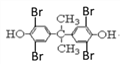 。
。
(1)B為![]() ,名稱為:環己醇。
,名稱為:環己醇。
(2)B(![]() )發生催化氧化生成C(
)發生催化氧化生成C(![]() ),所以B→C還需要的反應試劑及條件是:O2、Cu、加熱;由已知③可得,C(
),所以B→C還需要的反應試劑及條件是:O2、Cu、加熱;由已知③可得,C(![]() )生成D(
)生成D(![]() )的反應是氧化反應。
)的反應是氧化反應。
(3)X(![]() )和丙酮發生取代反應生成Y(
)和丙酮發生取代反應生成Y(![]() ),化學方程式為:2
),化學方程式為:2![]() +
+![]()
![]()
![]() +H2O。
+H2O。
(4)四溴雙酚A( )能和
)能和
(5)D結構簡式為![]() ,符合下列條件的D的同分異構體:①含有兩個甲基和兩種官能團,則官能團為醛基和羥基或碳碳雙鍵和
,符合下列條件的D的同分異構體:①含有兩個甲基和兩種官能團,則官能團為醛基和羥基或碳碳雙鍵和![]() (羧基或酯基);②能使溴的CCl4溶液褪色,則含碳碳雙鍵;③能發生銀鏡反應說明含有醛基。綜合以上三點,符合條件的D的同分異構體應為甲酸酯,有:HCOOCH=CHCH(CH3)2、HCOOCH=C(CH3)CH2CH3、HCOOC(CH3)=CHCH2CH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH2CH3)=CHCH3、HCOOCH2CH=C(CH3)2、HCOOCH(CH3)CH=CHCH3、HCOOCH2C(CH3)=CHCH3、HCOOC(CH3)2CH=CH2、HCOOCH(CH3)C(CH3)=CH2,共10種。
(羧基或酯基);②能使溴的CCl4溶液褪色,則含碳碳雙鍵;③能發生銀鏡反應說明含有醛基。綜合以上三點,符合條件的D的同分異構體應為甲酸酯,有:HCOOCH=CHCH(CH3)2、HCOOCH=C(CH3)CH2CH3、HCOOC(CH3)=CHCH2CH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH2CH3)=CHCH3、HCOOCH2CH=C(CH3)2、HCOOCH(CH3)CH=CHCH3、HCOOCH2C(CH3)=CHCH3、HCOOC(CH3)2CH=CH2、HCOOCH(CH3)C(CH3)=CH2,共10種。
(6)用逆推法分析:可用CH2=CHCOOCH2CH3發生加聚反應生成![]() ;由已知得到啟發,可用CH2=CH2、CH3CH2OH、CO和O2反應生成CH2=CHCOOCH2CH3;一定條件下乙烯和水發生加成反應生成CH3CH2OH,所以利用乙烯為有機原料(無機物和反應條件自選)合成聚合物涂料
;由已知得到啟發,可用CH2=CH2、CH3CH2OH、CO和O2反應生成CH2=CHCOOCH2CH3;一定條件下乙烯和水發生加成反應生成CH3CH2OH,所以利用乙烯為有機原料(無機物和反應條件自選)合成聚合物涂料![]() 的流程圖為:
的流程圖為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.對于有氣體參與的反應,增大壓強,活化分子總數增多,化學反應速率增大
B.對放熱反應而言,升高溫度,活化分子百分數減少,化學反應速率減小
C.活化分子間發生的碰撞為有效碰撞
D.使用催化劑,活化分子百分數增多,化學反應速率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】500 多年前,一艘載著天然蘇打晶體(Na2CO3·10H2O)的商船在航行中擱淺,船員們便在附近的沙灘上用幾塊蘇打晶體支鍋煮飯。之后他們驚奇地發現,在蘇打與沙粒接觸的地方出現了許多晶瑩發亮的珠子。回答下列問題:
(1)沙灘上沙粒的主要成分為_______(填化學式)。
(2)上述晶瑩發亮的珠子可能是______(填字母)。
A. 水晶顆粒 B.無水碳酸鈉 C.晶體硅 D.玻璃珠
(3)生成該珠子時發生反應的化學方程式為_____________。
(4)氫氟酸常用作玻璃的蝕刻劑,原因是______________(用化學方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組在實驗室進行硫的化合物系列實驗。
Ⅰ.驗證H2SO3的酸性比H2CO3強,甲同學設計下圖裝置。

(1)試劑X的作用是_______。
(2)當觀察到_______,即證明H2SO3的酸性比H2CO3強。
Ⅱ.研究鐵與硫酸的反應。
已知: 濃H2SO4的沸點為338.2℃。
a.乙同學設計如下表所示的實驗1、2:
實驗 | 試劑 | 現象 | |
| 1 | 螺旋狀鐵絲、稀硫酸 | 鐵絲表面有大量氣體產生。 |
2 | 螺旋狀鐵絲、濃硫酸 | 鐵絲表面迅速發黑(Fe3O4),有少量氣體產生,反應很快停止。 | |
(3)上述實驗中,鐵絲繞成螺旋狀的目的是_______。
(4)實驗1中,鐵與稀硫酸反應的離子方程式為_______。
(5)實險2中的現象常被稱為_______。
b.丙同學設計如圖所示裝置的實驗3:
加熱試管A,溫度保持在250℃~300℃,產生大量氣體,B中品紅褪色,D處始終未檢測到可燃性氣體,實驗結束后,檢驗到A的溶液中既有Fe3+又有Fe2+。
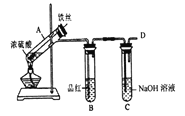
(6)A中產生的氣體是_______; 請設計實驗方案檢測裝置A的溶液中含有Fe3+_______ (簡要說明操作、試劑、現象和結論)。
(7)分析實驗1、2、3,可知影響鐵和硫酸反應產物多樣性的因素有_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將下列物質按酸、堿、鹽分類排列,正確的是( )
A. 硫酸 純堿 硫酸鈣 B. 鹽酸 燒堿 硫酸亞鐵
C. 碳酸 乙醇 燒堿 D. 磷酸 熟石灰 苛性鈉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上消除氮氧化物的污染,可用如下反應:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在溫度T1和T2時,分別將0.50mol CH4和1.2mol NO2充入體積為1L的密閉容器中,測得n(CH4)隨時間變化數據如下表:下列說法不正確的是( )
溫度 | 時間/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min內,T1時CH4的化學反應速率比T2時小
B.溫度:T1<T2
C.a<0
D.平衡常數:K(T1)<K(T2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】離子方程式H+ + OH-= H2O可表示的化學方程式是( )
A. 鹽酸與氫氧化銅的反應 B. 硫酸氫鈉與氫氧化鈉的反應
C. 硫酸與氫氧化鎂的反應 D. 鹽酸與氨水的反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com