
(14分)下圖是元素周期表的一部分
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | | |
| ⑥ | | | | | | | | | | | | ⑦ | | | | ⑧ | |
| | | | ⑨ | | | | ⑩ | | | | | | | | | | |
| 元素代號 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(1)  ;14 (2)分子間存在氫鍵,H2O分子發生締合
;14 (2)分子間存在氫鍵,H2O分子發生締合
(3)2OH— + Be(OH)2=BeO22—+ 2H2O (4)①R 和U ② p(1分) IIIA(1分)120°
解析試題分析:(1)根據元素在周期表中的位置可知,元素⑨是鈦元素,原子序數是22,因此根據核外電子排布規律其知的價電子軌道表示式為 。元素⑩是鐵,其次外層電子數為14個。
。元素⑩是鐵,其次外層電子數為14個。
(2)元素⑤是水,水分子間存在氫鍵,H2O分子發生締合,因此測定結果比理論值高。
(3)②、⑦分別是Be和Al,氫氧化鋁是兩性氫氧化物,則元素②的氫氧化物與NaOH溶液反應的離子方程式為2OH— + Be(OH)2=BeO22—+ 2H2O。
(4)由元素的電離能可以看出,Q的電離能很大,可能為零族元素,R和U的第一電離能較小,第二電離能劇增,故表現+1價,最外層電子數為1,二者位于同一族,S的第一、第二電離能較小,第三電離能劇增,故表現+2價,最外層電子數為2,T的第一、第二、第三電離能較小,第四電離能劇增,表現+3價,最外層電子數為3,則
①由上述分析可知,R和U的第一電離能較小,第二電離能劇增,故表現+1價,最外層電子數為1,二者位于同一族。
②由上述分析可知,T的第一、第二、第三電離能較小,第四電離能劇增,表現+3價,最外層電子數為3,可能為P區元素,位于第ⅢA族;若T為第二周期元素,則T是B元素。Z是第三周期元素中原子半徑最小的主族元素,因此Z是氯元素,則T、Z形成的化合物是BCl3,B原子的價層電子對數是3個,且不存在孤對電子,所以是平面三角形結構,分子鍵角為120°。
考點:考查元素周期表的結構、元素周期律的應用


 優學名師名題系列答案
優學名師名題系列答案科目:高中化學 來源: 題型:填空題
X、Y、Z、W、Q五種前四周期元素,原子序數依次增大。已知五種元素中只有一種為金屬元素, XW2是通常呈液態的有機物,元素W的原子序數等于元素Z的原子序數加8,Q的最外層電子數為1,次外層電子數等于Y和W2 - 最外層電子數之和。根據以上信息回答下列問題:(用元素符號或化學式等化學用語回答)
(1)XW2的電子式為 。
(2)Y原子中電子運動狀態有 種, Z的氣態氫化物在同主族元素氣態氫化物中最高是因為 。
(3)Q在周期表中的位置 ,其基態原子簡化電子排布式為 。交警可以用H2SO4酸化的K2 Cr2O7溶液檢測駕駛員是否酒駕,其產物為乙酸、Q3+等。
請寫出此原理的離子方程式 。
(4)含W的兩種元素種類相同的酸式銨鹽溶液反應的離子方程式
。
(5)某種燃料電池一極通乙醇的最簡單同系物蒸氣,一極通Z2,以NaOH溶液為電解液。請寫出該原電池負極的電極反應式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
元素周期表與元素周期律在學習、研究和生產實踐中有很重要的作用。下表列出了①~⑨九種元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(11分)A、B、C、D四種短周期元素。原子序數依次增大,A原子的最外層上有4個電子;B的陰離子和C的陽離子具有相同的電子層結構,兩元素的單質反應,生成一種淡黃色的固體甲;D的L層電子數等于K、M兩個電子層上的電子數之和。
(1)寫出下列元素的名稱:A_______,B ,C_______,D 。
(2)D的質子數和中子數相等,D的原子組成符號為 ,它的最高價為___________價。
(3)用電子式表示A、D兩元素形成AD2的過程: ;
寫出C2B2的電子式 。
(4)氫元素與B、D 均可以形成原子個數比為2:1的化合物,H2B的熔沸點高于H2D的原因是
。
(5)寫出甲和A的最高價氧化物反應的化學方式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(9分)A、B、C三種元素的原子具有相同的電子層數,而B的核電荷數比A大1,C原子的電子總數比B原子的電子總數多4; 1molA的單質跟足量鹽酸反應,可置換出標準狀況下22.4L的H2,這時A轉變為與氖原子具有相同電子層結構的離子。試請回答:
(1)用電子式表示A和C組成的化合物的形成過程為______________________;
(2)B離子的電子式是 ,與B的離子具有相同電子數的分子中,有一種分子可與鹽酸化合生成鹽,該分子的電子式是 ;
(3)周期表中與C上下相鄰的同族元素形成的氣態氫化物中,沸點最高的是 ,(填氫化物化學式),原因是 ;
(4)寫出B最高價氧化物的水化物和C最高價氧化物的水化物之間反應的離子方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)下表為元素周期表的一部分,所標的字母各代表一種化學元素。
試回答下列問題:
(1)元素M在第________周期第________族。
(2)C的10電子氫化物的電子________,D的簡單氫化物的空間結構為________________。
(3)試寫出一種由上述3種元素組成的不含有金屬元素的離子化臺物____________(填化學式)。
(4)上述元素中非金屬性最強的元素是_____________(填元素符號),元素最高價氧化物對應水化物酸性最強的物質是_____________(填化學式)。
(5)寫出G與I的最高價氧化物對應水化物反應的離子方程式:____________________
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(16分)下表是元素周期表的一部分,表中所列的字母分別代表某一化學元素。
| | | | |||||||||||||||
| | | | | h | | | | | |||||||||
| a | c | f | | i | | | m | ||||||||||
| | | | e | | | | | | | | | | g | | k | | |
| | d | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(16分)X、Y、Z三種短周期元素,其單質在常溫下均為無色氣體,它們的原子序數之和為16。在適當條件下三種單質兩兩化合,可發生如右圖所示變化。己知l個B分子中含有Z元素的原子個數比C分子中含有Z元素的原子個數少1個。請回答下列問題: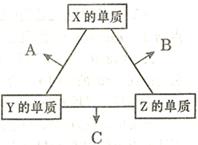
(1)由 X、Y、Z三種元素共同組成的三種不同種類的常見化合物的化學式為 ,相同濃度上述水溶液中由水電離出的c(H+)最小的是 (填寫化學式)。
(2)Allis-Chalmers制造公司發現可以用C作為燃料電池的燃料,以氫氧化鉀溶液為介質,反應生成對環境無污染的常見物質,試寫出該電池負極的電極反應式 ,溶液中OH-向 極移動(填“正”或“負”)。
(3)Z分別與X、Y兩元素可以構成18個電子分子甲和乙,其分子中只存在共價單鍵,常溫下甲、乙均為無色液體,甲隨著溫度升高分解速率加快。
①乙能夠將CuO還原為Cu2O,已知每lmol乙參加反應有4mole- 轉移,該反應的化學方程式為 。
②將銅粉末用10%甲和3.0mol?L-1H2SO4混合溶液處埋,測得不同溫度下銅的平均溶解速率如下表:
| 溫度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 銅的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com