
【題目】在標準狀況下,11.2L 乙炔跟溴起加成反應,理論上有多少克溴參加反應____?
 小學奪冠AB卷系列答案
小學奪冠AB卷系列答案 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 木材、紡織品浸過水玻璃后,具有防腐性能且不易燃燒
B. 金屬鎂的熔點高達2800℃,是優質的耐高溫材料
C. 氧化鐵紅顏料跟某些油料混合,可以制成防銹油漆
D. 由于銅鹽能殺死某些細菌,并能抑制藻類生長,因此游泳場館常用硫酸銅作池水消毒劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷酸鐵鋰電池具有高效率輸出、可快速充電、對環境無污染等優點,其工作原理如圖。M電極材料是金屬鋰和碳的復合材料(碳作為金屬鋰的載體),電解質為一種能傳導Li+的高分子材料,隔膜只允許 Li+通過,電池反應式
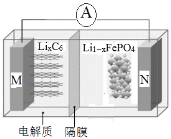
為LixC6+Li1-xFePO4 ![]() LiFePO4+6C。下列說法正確的是
LiFePO4+6C。下列說法正確的是
A.放電時Li+從右邊移向左邊
B.放電時M是負極,電極反應式為:C6x--xe-=6C
C.充電時N極連接電源的正極,電極反應式為:LiFePO4-xe-=Li1-xFePO4+xLi+
D.充電時電路中通過0.5mol電子,消耗36gC
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式與所述事實相符且正確的是
A. 氯氣和水反應:Cl2 + H2O ![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
B. 碳酸鈣與醋酸溶液反應:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C. 200 mL 2 mol/L的FeBr2溶液中通入11.2 L標準狀況下的氯氣:
4Fe2+ + 6Br-+ 5Cl2 == 4Fe3+ + 3Br2 + 10Cl-
D. Na2S水解的離子方程式:S2- + 2H2O ![]() H2S + 2OH-
H2S + 2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分別將鎂條和鋁條平行插人盛有一定濃度稀鹽酸、NaOH的燒杯中,用導線和電流計連接成兩個原電池,裝置如圖所示。原電池工作時,下列敘述正確的是
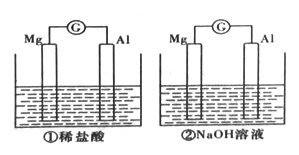
A. 因為Mg比Al活潑,所以兩個原電池中負極都是Mg
B. 兩個原電池中,電子都是由鎂條通過導線流向鋁條
C. 兩個原電池中,反應放出的能量都完全轉化成電能
D. 兩個原電池中,正極都有氫氣生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.常溫常壓下,斷裂1mol(理想)氣體分子化學鍵所吸收的能量或形成1mol(理想)氣體分子化學鍵所放出的能量稱為鍵能(單位為KJ.mol-1)下表是一些鍵能數據(KJ·mol-1)
化學鍵 | 鍵能 | 化學鍵 | 鍵能 | 化學鍵 | 鍵能 |
C-F | 427 | C-Cl | 330 | C-I | 218 |
H-H | 436 | S=S | 255 | H-S | 339 |
回答下列問題:
寫出H2(g)與S2(g)反應生成H2S(g)的熱化學方程式____________________________。
Ⅱ.某溫度時,在2 L密閉容器中,三種氣態物質X、Y、Z的物質的量(n)隨時間(t)變化的曲線如圖所示,由圖中數據分析可得:

(1)該反應的化學方程式為___________________。
(2)反應開始至2 min,用Y表示的平均反應速率為_____________,X的轉化率為_________。
(3)在一定溫度下,下列情況可作為上述反應達到反應限度的標志的是________。
A.X、Y、Z的濃度相等
B.X、Y、Z的分子數比為3︰1︰2
C.Z的生成速率是Y的生成速率的二倍
D.單位時間內生成n mol Y,同時生成3n mol X
Ⅲ.如圖是甲烷燃料電池原理示意圖,回答下列問題:

①電池的負極是________(填“a”或“b”)電極,該極的電極反應式為: ________________。
②電池工作一段時間后電解質溶液的pH__________(填“增大”“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【加試題】鐵在工業和生活中都具有非常重要的應用。某含鐵化合物W,為探究其成分,化學興趣小組的同學取化合物W粉末進行試驗。經組成分析,該粉末除Fe外還有O和另一未知元素共三種元素。另取2.22g化合物W的粉末溶于適量稀硫酸,向反應后的溶液中加入含有3.20gNaOH的溶液,恰好完全反應。過濾,將洗滌后的沉淀充分灼燒,得到紅棕色粉末1.60g;將所得濾液在一定條件下蒸發灼燒可得到一種純凈的不含結晶水的鹽7.10g。請回答:
(1)則另一未知元素為________(填化學式)。
(2)①該化合物W的化學式為________________。
②該化合物W與適量稀硫酸反應的化學方程式___________________。
(3)草酸鈷是廣泛應用于磁性材料、電池材料、及超硬材料等領域。某研究小組在實驗室探究CoC2O4分解反應的平衡常數。將一定量純凈的CoC2O4粉末置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解的平衡:
CoC2O4(S)![]() CoO(S)+CO(g)+CO2(g)
CoO(S)+CO(g)+CO2(g)
實驗測得不同溫度下的平衡數據列于下表:
溫度/℃ | 240 | 250 | 260 | 270 |
平衡總壓強/kp | 5.7 | 8.3 | 12.0 | 17.1 |
平衡總濃度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
由表中數據,列式計算250℃時CoC2O4分解平衡常數 。 該反應的焓變△H 0(填“>”、“=”或“<”)。
(4)溫度加熱至350℃,CO2的體積分數開始發生變化,體積分數和溫度的關系如下:試畫出CO的體積分數隨溫度升高的曲線
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com