
Ⅰ. 在實驗室利用下列裝置,可制備某些氣體并驗證其化學性質。
完成下列表格:
| 序號 | 氣體 | 裝置連接順序(填字母) | 制備反應的化學方程式 |
| (1) | 乙烯 | _________________ | _________________ |
| (2) | 乙炔 | A→C→E | _________________ |

 =_______________。
=_______________。 (12分,每空2分)Ⅰ.(1)B→D→E 
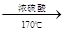
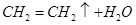
(2)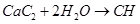

Ⅱ. (1)A、B、D、E、F;(2)飽和食鹽水 (3)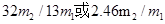
解析試題分析:Ⅰ.①實驗室制取乙烯利用的是乙醇在濃硫酸的作用下加熱到170℃通過消去反應制備乙烯。由于生成的乙烯中含有SO2,所以在通過酸性高錳酸鉀溶液檢驗乙烯的性質之前,要首先除去SO2,所用試劑是氫氧化鈉溶液,即連接順序是B→D→E ,反應的方程式是
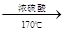
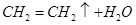 。
。
②實驗室制取乙炔,利用的是電石和飽和食鹽水反應制備,反應的方程式是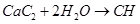
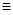
 。
。
Ⅱ. (1)測定電石樣品的純度,則可以通過測量電石與水反應生成的乙炔來完成。由于乙炔能被溴的四氯化碳溶液吸收,通過稱量反應前后的質量即可得出生成的乙炔質量。但由于生成的乙炔氣體中含有H2S和PH3,所用需要分別通過濃硫酸和硫酸銅除去。又因為裝置中含有沒有被完全排出的氣體,因此還需要借助于A裝置,因此正確的連接順序是A、B、D、E、F。
(2)為保證測定的精度,要求產生乙炔的氣流較為平緩,在分液漏斗中應裝入的液體是飽和食鹽水。
(3)F吸收乙炔前后的質量差為m2g,則生成的乙炔質量就是m2g,所用根據方程式可知碳化鈣的質量是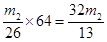 ,因此電石樣品中CaC2質量分數
,因此電石樣品中CaC2質量分數 =
=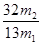 。
。
考點:考查乙烯、乙炔的實驗室制備、電石純度測定的實驗探究
點評:該題是高考中的常見考點和題型,屬于中等難度試題的考查,試題綜合性強,側重對學生能力的培養和解題方法的指導與訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力,有利于培養學生的邏輯推理能力和規范嚴謹的實驗設計能力,提高學生的學科素養。該類試題綜合性強,理論和實踐的聯系緊密,有的還提供一些新的信息,這就要求學生必須認真、細致的審題,聯系所學過的知識和技能,進行知識的類比、遷移、重組,全面細致的思考才能得出正確的結論。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:實驗題
CaCO3廣泛存在于自然界,是一種重要的化工原料。大理石主要成分為CaCO3,另外有少量的含硫化合物(如FeS等)。實驗室用大理石和稀鹽酸反應制備CO2氣體。下列裝置可用于CO2氣體的提純和干燥。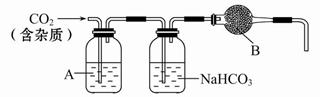
完成下列填空:
(1)用濃鹽酸配制1∶1(體積比)的稀鹽酸(約6 mol·L-1),應選用的儀器是_____。
a.燒杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述裝置中,A是_____溶液,NaHCO3溶液可以吸收_____。
(3)上述裝置中,B物質是_____。把這個實驗得到的氣體收集起來,用來測定CO2的分子量,如果B物質失效,測定結果_____(填“偏高”、“偏低”或“不受影響”)。
(4)一次性飯盒中石蠟(高級烷烴)和CaCO3在食物中的溶出量是評價飯盒質量的指標之一,測定溶出量的主要實驗步驟設計如下:
剪碎、稱重→浸泡溶解→過濾→殘渣烘干→冷卻、稱重→恒重,為了將石蠟溶出,應選用的試劑是_____,碳酸鈣溶出,應選用的試劑是_____。
a.氯化鈉溶液 b.稀醋酸
c.稀硫酸 d.正己烷
(5)在溶出量測定實驗中,為了獲得石蠟和碳酸鈣的最大溶出量,應先溶出_____,原因是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
選用適當裝置、試劑和方法可制備中學化學中的幾種常見氣體。請填寫表中的空格(從①~⑩中選擇,填序號):
| 實驗 | 氣體 | 所用裝置 | 氣體性質 | 干燥該氣體選用的試劑 |
| (1) | | ③ | 其水溶液顯堿性 | |
| (2) | | | 1mol最多能與2molH2反應 | ⑩ |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
已知用P2O5作催化劑,加熱乙醇可制備乙烯,反應溫度為80℃~210℃。某研究性小組設計了如下的裝置制備并檢驗產生的乙烯氣體(夾持和加熱儀器略去)。

(1)儀器a的名稱為_________________
(2)用化學反應方程式表示上述制備乙烯的原理______________________________。
(3)已知P2O5是一種酸性干燥劑,吸水放大量熱,在實驗過程中P2O5與乙醇能發生作用,因反應用量的不同,會生成不同的磷酸酯,它們均為易溶于水的物質,沸點較低。寫出乙醇和磷酸反應生成磷酸二乙酯的化學方程式(磷酸用結構式表示為 )__________________________________。
)__________________________________。
(4)某同學認為用上述裝置驗證產生了乙烯不夠嚴密,理由是___________________。
(5)某同學查文獻得知:40%的乙烯利(分子式為C2H6ClO3P)溶液和NaOH固體混和可快速產生水果催熟用的乙烯,請在上述虛線框內畫出用乙烯利溶液和NaOH固體制取乙烯的裝置簡圖(夾持儀器略)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
不久前,一則“食用撒了魚浮靈的魚蝦可能致癌”的微博在網上熱傳。“魚浮靈”的化學成分實為過碳酸鈉,使用不當會讓魚損傷,過碳酸鈉本身無毒無害,對人體不會有危害。過碳酸鈉,俗稱固體雙氧水,化學式為2Na2CO3·3H2O2,是一種無機鹽,是白色顆粒狀粉末,可以分解為碳酸鈉和過氧化氫。某探究小組制備過碳酸鈉并測定樣品中H2O2的含量,其制備流程和裝置示意圖如下:
已知:50 °C時 2Na2CO3·3H2O2 (s) 開始分解
主反應 2Na2CO3 (aq) + 3H2O2 (aq) 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反應 2H2O2 = 2H2O + O2↑
滴定反應 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 = 3K2SO4 + 6MnSO4+10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
根據以上信息回答下列問題:
(1)推測圖中支管的作用可能是 。
(2)步驟①的關鍵是控制溫度,結合裝置圖歸納其措施有 、
和 。
(3)在濾液X中加入適量NaCl固體或無水乙醇均可析出過碳酸鈉,原因是 。
(4)步驟③中選用無水乙醇洗滌產品的目的是 。
(5)測定樣品中H2O2的質量分數的方法是:準確稱取0.2000g過碳酸鈉樣品于250 mL 錐形瓶中,加50 mL 蒸餾水溶解,再加50 mL 2.000 mol·L-1 H2SO4 (H2SO4過量),用0.002000mol·L-1 KMnO4標準溶液滴定至終點時消耗30.00 mL。
①滴定前,滴定管需用KMnO4標準溶液潤洗2~3次,潤洗的操作方法是:關閉酸式滴定管活塞,向滴定管中注入少量KMnO4標準 。
②上述樣品中H2O2的質量分數計算表達式為 (只列出算式,不作任何運算!H2O2的式量為34.00)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
無水氯化鋁是白色晶體,易吸收水分,在178℃升華,裝有無水氯化鋁露置于潮濕空氣中會爆炸并產生大量白霧,工業上由金屬與氯氣作用或由無水氯化氫氣體與熔融Al作用而制得,某課外活動小組在實驗室內通過下列裝置(如下圖)制取少量純凈的無水氯化鋁。
試回答以下問題:
(1)裝置A中反應的化學方程式
(2)為使實驗成功,A和B間需要加適當的裝置,請將它畫在框內,并注明其中盛放的藥品。如果A產生的氣體直接進入B中,實驗產生的不良后果是 。
(3)進行實驗時,應先點燃(填寫字母,下同) 處的酒精燈,然后再點燃
處的酒精燈。
(4)在C處可以收集到純凈的氯化鋁,原因是 。
(5)裝置D的作用是 。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列實驗操作不能達到預期實驗目的的是
| | 實驗目的 | 實驗操作 |
| A | 鑒別乙酸乙酯和乙酸 | 分別加入飽和Na2CO3溶液 |
| B | 比較Fe和Cu的金屬活動性 | 分別加入濃硝酸 |
| C | 比較H2O和乙醇中羥基氫的活潑性 | 分別加入少量Na |
| D | 比較I2在H2O和CCl4中的溶解度 | 向I2水中加入CCl4,振蕩 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下圖所示的實驗,能達到實驗目的的是
| A | B | C | D |
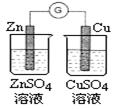 |  |  |  |
| 驗證化學能轉化為電能 | 驗證溫度對平衡移動的影響 | 驗證鐵發生析氫腐蝕 | 驗證非金屬性Cl> C > Si |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列對實驗現象的解釋與結論,正確的是( )
| 選項 | 實驗操作 | 實驗現象 | 解釋與結論 |
| A | 向雞蛋清溶液中加入飽和(NH4)2SO4溶液 | 有白色沉淀產生 | 蛋白質發生了變性 |
| B | 向某溶液中加入鹽酸酸化的BaCl2溶液 | 有白色沉淀產生 | 該溶液中一定含有SO42- |
| C | 向甲苯中滴入少量濃溴水,振蕩,靜置 | 溶液分層,上層呈橙紅色,下層幾乎無色 | 甲苯和溴水發生取代反應,使溴水褪色 |
| D | 向蔗糖中加入濃硫酸 | 變黑,放熱,體積膨脹,放出刺激性氣體 | 濃硫酸具有脫水性和強氧化性,反應中生成C、SO2和CO2等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com