
【題目】如圖是一種綜合處理SO2廢氣的工藝流程。下列說法正確的是( )

A.向B溶液中滴加KSCN溶液,溶液可能變為紅色
B.溶液B轉化為溶液C發生反應的離子方程式為4H++2Fe2++O2=2Fe3++2H2O
C.溶液酸性:A>B
D.加氧化亞鐵可以使溶液C轉化為溶液A
科目:高中化學 來源: 題型:
【題目】五氧化二釩廣泛用于冶金、化工等行業,用作合金添加劑、生產硫酸或石油精煉用的催化劑等。為回收利用含釩催化劑,研制了一種利用廢催化劑(含有V2O5、VOSO4、不溶性硅酸鹽)回收V2O5的新工藝流程如下:
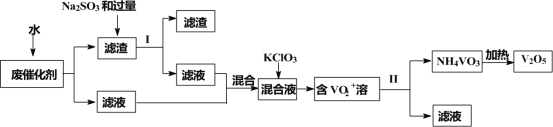
已知:①部分含釩物質常溫下在水中的溶解性如表所示:
物質 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 難溶 | 難溶 | 易溶 |
②VO2++2OH-![]() VO3-+H2O
VO3-+H2O
回答下列問題:
(1)用水浸泡廢催化劑,為了提高單位時間內廢釩的浸出率,可以采取的措施為____________(寫一條)。
(2)濾液1和濾液2中釩的存在形式相同,其存在形式為____________(填離子符號)。
(3)在濾渣1中加入Na2SO3和過量H2SO4溶液發生反應的化學方程式為____________。
(4)生成VO2+的反應中消耗1molKClO3時轉移6mol電子,該反應的離子方程式為____________。
(5)在第Ⅱ步中需要加入氨水,請結合化學用語,用平衡移動原理解釋加入氨水的一種作用為____________。
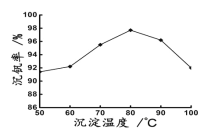
(6)最后釩以NH4VO3的形式沉淀出來。以沉釩率(NH4VO3沉淀中V的質量和廢催化劑V的質量之比)表示該步反應釩的回收率。請結合如圖解釋在第Ⅱ步中溫度超過80°C以后,沉釩率下降的可能原因是____________;____________(寫兩條)。
(7)該工藝流程中可以循環利用的物質為____________。
(8)測定產品中V2O5的純度:
稱取ag產品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L1(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2mol·L1KMnO4溶液滴定過量的(NH4)2Fe(SO4)2至終點,消耗KMnO4溶液的體積為b2mL。已知MnO4-被還原為Mn2+,假設雜質不參與反應。則產品中V2O5(摩爾質量:182g·mol1)的質量分數是____________。(列出計算式)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,隨著聚酯工業的快速發展,氯氣的需求量和氯化氫的產出量也隨之迅速增長。因此,將氯化氫轉化為氯氣的技術成為科學研究的熱點。回答下列問題:
(1)Deacon發明的直接氧化法為:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下圖為剛性容器中,進料濃度比c(HCl) ∶c(O2)分別等于1∶1、4∶1、7∶1時HCl平衡轉化率隨溫度變化的關系:
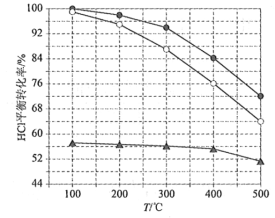
可知反應平衡常數K(300℃)____________K(400℃)(填“大于”或“小于”)。設HCl初始濃度為c0,根據進料濃度比c(HCl)∶c(O2)=1∶1的數據計算K(400℃)=____________(列出計算式)。按化學計量比進料可以保持反應物高轉化率,同時降低產物分離的能耗。進料濃度比c(HCl)∶c(O2)過低、過高的不利影響分別是____________。
(2)Deacon直接氧化法可按下列催化過程進行:CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1,CuCl(s)+
Cl2(g) ΔH1=83 kJ·mol-1,CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1,則4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
Cl2(g) ΔH2=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1,則4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定溫度的條件下,進一步提高HCl的轉化率的方法是______________。(寫出2種)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家開發設計一種天然氣脫硫裝置,利用如圖裝置可實現:H2S+O2=H2O2 +S↓。已知甲池中有如下的轉化:


下列說法錯誤的是( )
A.該裝置將光能只轉化為電能
B.該裝置工作時,溶液中的H+從甲池經過全氟磺酸膜進入乙池
C.甲池碳棒上發生電極反應:AQ+2H+ +2e- =H2AQ
D.乙池①處發生反應:H2S+I3-=3I-+S↓+2H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】制備(NH4)2Fe(SO4)2·6H2O 的實驗中,需對過濾出產品的母液(pH<1)進行處理。室溫下,分別取母液并向其中加入指定物質,反應后的溶液中主要存在的一組離子正確的是
A.通入過量Cl2:Fe2+、H+、![]() 、Cl、
、Cl、![]()
B.加入少量NaClO溶液:![]() 、Fe2+、H+、
、Fe2+、H+、![]() 、ClO
、ClO
C.加入過量NaOH 溶液:Na+、Fe2+、![]() 、
、![]() 、OH
、OH
D.加入過量NaClO和NaOH的混合溶液:Na+、![]() 、Cl、ClO、OH
、Cl、ClO、OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素W、X、Y、Z的原子序數依次增加。A是元素Y的單質。常溫下,甲的濃溶液和A發生鈍化。丙、丁、戊是由這些元素組成的二元化合物,且丙是無色氣體。上述物質的轉化關系如圖所示。下列說法正確的是

A. 丁和戊中所含元素種類相同
B. 簡單離子半徑大小:X<Y
C. 氣態氫化物的還原性:X>Z
D. Y的簡單離子與Z的簡單離子在水溶液中可大量共存
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家設計二氧化碳熔鹽捕獲及電化學轉化裝置,其示意圖如下: 下列說法不正確的是( )
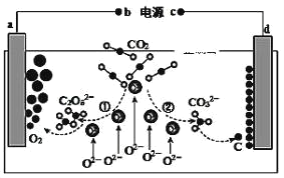
A.b 為電源的正極
B.①②中,捕獲 CO2 時碳元素的化合價發生了變化
C.a 極的電極反應式為 2C2O52--4e-=4CO2 +O2
D.上述裝置存在的電解總反應式為:CO2 ![]() C+O2
C+O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備 1,2-二溴乙烷的反應原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反應有:乙醇在濃硫酸的存在下在 l40℃脫水生成乙醚。用少量的溴和足量的乙醇制備 1,2-二溴乙烷的裝置如下圖所示:
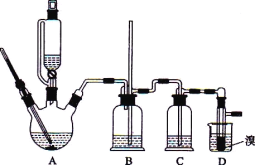
有關數據列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
狀態 | 無色液體 | 無色液體 | 無色液體 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸點/℃ | 78.5 | 132 | 34.6 |
熔點/℃ | 一l30 | 9 | -1l6 |
回答下列問題:
(1)在此制備實驗中,要盡可能迅速地把反應溫度提高到 170℃ 左右,其最主要目的是_____;(填正確選項前的字母)
a.引發反應 b.加快反應速度 c.防止乙醇揮發 d.減少副產物乙醚生成
(2)在裝置C中應加入_____,其目的是吸收反應中可能生成的酸性氣體:(填正確選項前的字母)
a.水 b.濃硫酸 c.氫氧化鈉溶液 d.飽和碳酸氫鈉溶液
(3)若產物中有少量未反應的 Br2,最好用_____洗滌除去;(填正確選項前的字母)
a.水 b.氫氧化鈉溶液 c.碘化鈉溶液 d.乙醇
(4)判斷該制各反應已經結束的最簡單方法是_____;
(5)若產物中有少量副產物乙醚,可用_____的方法除去;
(6)反應過程中應用冷水冷卻裝置D,其主要目的是____;但又不能過度冷卻(如用冰水),其原因是_____
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com