
(11分)回答下列問題
(1)在2FeBr2+3Cl2=2FeCl3+2Br2的反應中,被氧化的元素是_____________
(2)鐵釘在氯氣中被銹蝕成棕褐色物質(zhì)FeCl3,而在鹽酸中生成淡綠色溶液(FeCl2);濃鹽酸中滴加KMnO4溶液產(chǎn)生黃綠色氣體(Cl2)。則Cl2、Fe3+、MnO4-氧化性由強到弱的順序是____________________。
(3)已知CuO具有氧化性,能夠和氨氣反應生成兩種單質(zhì),請寫出在加熱條件下CuO和NH3反應的化學方程式____________________________________________。
(4)在一定條件下,RO3n-和Cl2可發(fā)生如下反應:RO3n-+Cl2+2OH-=RO42-+2Cl-+H2O
由以上反應可知在上述過程中RO3n-被________________(填“氧化”或“還原”),RO3n-中元素R的化合價是______________。
(11分)(1)Fe(2分)和Br(2分) (2)MnO4->Cl2>Fe3+ (2分)
(3)3CuO+2NH3 3Cu+N2+3H2O(2分)(4)氧化(1分) +4(2分)
3Cu+N2+3H2O(2分)(4)氧化(1分) +4(2分)
解析試題分析:(1)根據(jù)反應的方程式可知,溴化鐵中鐵元素的化合價從+2價升高到+3價,被氧化。而溴元素的化合價溴-1價升高到0價,被氧化。
(2)在氧化還原反應中氧化劑的氧化性強于氧化產(chǎn)物的,所以反應中的實驗現(xiàn)象可判斷,Cl2、Fe3+、MnO4-氧化性由強到弱的順序是MnO4->Cl2>Fe3+。
(3)因為氧化銅具有氧化性,所以根據(jù)原子守恒可知,兩種單質(zhì)應該是氮氣和銅,則反應的化學方程式是3CuO+2NH3 3Cu+N2+3H2O。
3Cu+N2+3H2O。
(4)氯元素的化合價降低,所以氯氣是氧化劑,則RO3n-被氧化,作還原劑。RO42-中R元素的化合價是+6價,所以根據(jù)電子的得失守恒可知,RO3n-中元素R的化合價是+(6-2)=+4價。
考點:考查氧化還原反應的有關計算、判斷以及氧化還原反應方程式的書寫
點評:該題是中等難度的試題,試題基礎性強,側(cè)重能力的培養(yǎng)。該題的關鍵是準確標出有關元素的化合價變化情況,然后根據(jù)氧化還原反應的有關概念靈活運用、計算判斷即可。


 暑假作業(yè)安徽少年兒童出版社系列答案
暑假作業(yè)安徽少年兒童出版社系列答案科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:
| c(b-a) |
| 25 |
| c(b-a) |
| 25 |
| 16c(b-a) |
| m |
| 16c(b-a) |
| m |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

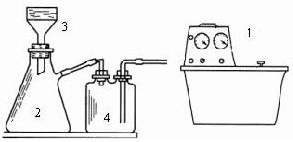
查看答案和解析>>
科目:高中化學 來源: 題型:
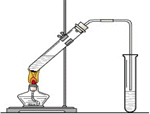 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題
查看答案和解析>>
科目:高中化學 來源:2011屆安徽省蚌埠二中高三第一學期期中考試化學試卷 題型:填空題
(8分)某無色透明溶液可能含有下列離子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取該溶液進行如下實驗:
①用藍色石蕊試紙檢測該溶液,試紙顯紅色;
②取溶液少許,加人銅片和稀硫酸共熱,產(chǎn)生無色氣體,該氣體遇到空氣立即變?yōu)榧t棕色;
③取溶液少許,加人氨水有白色沉淀生成,繼續(xù)加人過量氨水,沉淀不消失;
④取溶液少許,滴人氯化鋇溶液產(chǎn)生白色沉淀;
⑤取實驗④后的澄清溶液,滴人硝酸銀溶液產(chǎn)生白色沉淀,再加人過量的稀硝酸,沉淀不消失。
請回答下列問題:
(1)在實驗①中,下圖所示的操作中正確的是___________(填代號)
(2)根據(jù)上述實驗判斷原溶液中肯定存在的離子是______________________,肯定不存在的離子是______________________。
(3)寫出與②實驗有關的離子方程式:
_____________________________________________________________
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com