
【題目】已知SO2通入BaCl2溶液無明顯現象。某同學利用如圖裝置探究SO2與BaCl2溶液反應生成白色沉淀的條件。下列判斷正確的是
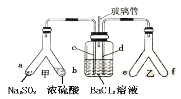
A.e、f兩管中的試劑可以分別是濃氨水和NaOH固體
B.乙中產生的一定為氧化性氣體,將BaSO3氧化為BaSO4沉淀
C.玻璃管的作用是連通大氣,使空氣中的氧氣進入廣口瓶,參與反應
D.c、d兩根導管都必須插入BaCl2溶液中,保證氣體與Ba2+充分接觸
【答案】A
【解析】
SO2與BaCl2反應產生沉淀,溶液中必須存在大量的SO32-,右側Y型管中應能生成堿性氣體或氧化性氣體,若是堿性氣體,溶液中存在大量的SO32-,若是氧化性氣體,溶液中可生成SO42-,則生成的沉淀可能為BaSO3或BaSO4;容器內壓強增大,溶液倒吸,氣體不容易導入,所以導氣管A的作用是保持集氣瓶內外氣壓平衡,以便左右兩邊產生的氣體順利導入,由此分析解答。
A. 若是堿性氣體,溶液中存在大量的SO32,所以e、f兩管中的試劑可以分別是濃氨水和NaOH,產生氨氣堿性氣體,故A正確;
B. SO2與BaCl2不反應,氧化性氣體將溶液中的亞硫酸根離子氧化成硫酸根離子,而不是將BaSO3氧化為BaSO4沉淀,故B錯誤;
C. 玻璃管的作用是連通大氣,平衡壓力,以便左右兩邊產生的氣體順利導入,故C錯誤;
D. 如果產生氨氣,氨氣極易溶于水,為防止倒吸,所以不能插入BaCl2溶液中,故D錯誤;
答案選A。


 考前必練系列答案
考前必練系列答案科目:高中化學 來源: 題型:
【題目】石灰石一石膏法脫硫是除去工業煙氣中所含SO2的重要方法,其工藝分為兩步:一是吸收SO2產生亞硫酸氫鈣,二是氧化產生石膏。某校化學興趣小組實驗模擬該工藝,設計置如下:
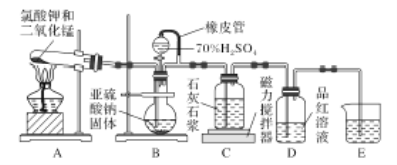
(1)裝置B模擬產生含SO2的工業煙氣,則E裝置的作用是_______________。
(2)實驗開始時,打開裝置B中分液漏斗的活塞,向燒瓶中逐滴滴加硫酸,D中立即產生了明顯的現象造成產生這一現象的原因是________。
A.該裝置的氣密性不夠好
B.滴加硫酸的速率較快
C.使用的硫酸濃度較小
D.石灰石漿液中碳酸鈣粉末的顆粒太小
(3)預計當裝置C中________________的現象時,關閉裝置B中分液漏斗的活塞,再點燃裝置A處的酒精燈。實際實驗過程中卻始終未觀察到C中產生這一現象,小組成員多次進行實驗探究,最終發現是藥品Na2SO3部分變質,請寫出定性實驗發現藥品Na2SO3問題的有關操作及現象:取少量的亞硫酸鈉固體于試管中,______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于合成氨N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ·mol-1反應,達到平衡后,以下分析正確的是
2NH3(g)ΔH=-92.4 kJ·mol-1反應,達到平衡后,以下分析正確的是
A. 升高溫度,對正反應的反應速率影響更大
B. 增大壓強,對正反應的反應速率影響更大
C. 減小反應物濃度,對逆反應的反應速率影響更大
D. 加入催化劑,對逆反應的反應速率影響更大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定條件下,下列選項所示的物質間轉化均能實現的是( )
A. N2![]() NO2
NO2![]() HNO3
HNO3
B. 石油![]() CH3CH3
CH3CH3![]() CH2BrCH2Br
CH2BrCH2Br
C. Al ![]() Al(NO3)3(aq)
Al(NO3)3(aq)![]() Al(OH)3(s)
Al(OH)3(s)
D. CH2=CH2 ![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲圖是部分短周期元素的常見化合價與原子序數的關系圖:
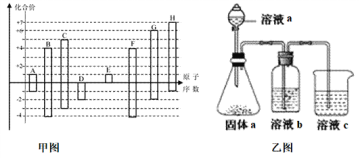
請回答下列問題:
(1)D元素在周期表中的位置為___________,D和G的簡單氫化物中沸點高的是___________(寫化學式),A和E形成的化合物的電子式為_____________。
(2)D、E、G、H的簡單離子半徑由大到小的順序為__________________________。(用化學式表示)
(3)H的最高價氧化物對應的水化物的濃溶液不穩定,受熱可分解,產物之一是H的單質,且當有28mol電子轉移時,常溫共產生9mol氣體,寫出該反應的化學方程式_________________。
(4)由上述元素中的幾種組成a、b、c各物質,某同學設計實驗用乙圖裝置證明元素B、C、F的非金屬性強弱(其中溶液b和溶液c均為足量)。
①溶液a和b分別為________,________(填化學式)。
②溶液c中的離子方程式為__________________________________________。
③請從原子結構的角度解釋非金屬性C>B的原因____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖容器底部是培養基,其中含有植物生長所需的全部養分,如果有人在配制培養基的礦質元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合鐵溶液、微量元素溶液,但缺少了一種必需元素,為補充這種元素,應添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋資源的利用具有廣闊前景。
(1)海水淡化的方法有_____(選填一種即可)。
(2)從海水中提取溴的主要步驟是向濃縮的海水中通入氯氣,將溴離子氧化,該反應的離子方程式是____。
(3)下圖是從海水中提取鎂的簡單流程。
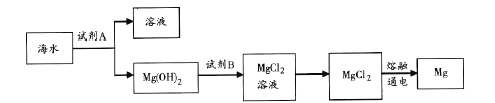
工業上常用于沉淀Mg2+的試劑A 的俗名是___,Mg(OH)2轉化為MgCl2 的離子方程式是_______。
(4)海帶灰中富含以I-形式存在的碘元素。實驗室提取I2 的途徑如下所示:
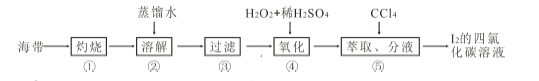
①灼燒海帶至灰燼時所用的主要儀器名稱是_______。步驟②加熱煮沸一會的目的是______________。
② 步驟④向濾液中加H2O2 和稀H2SO4 溶液,寫出該反應的離子方程式_______________。反應結束后,再加入CCl4 作萃取劑,振蕩、靜置,可以觀察到CCl4 層呈____________色。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,使H2和O2的混合氣體26g充分發生反應,所得產物在適當溫度下跟足量的固體Na2O2反應,使固體增重2g。原混合氣體中H2和O2的物質的量之比為( )
A.1:10B.9:1C.4:1D.4:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組數據中,前者剛好是后者兩倍的是 ( )
A. 2 mol H2O的摩爾質量和1 mol H2O的摩爾質量
B. 200 mL 1 mol·L-1氯化鈣溶液中c(Cl-)和100 mL 2 mol·L-1氯化鉀溶液中c(Cl-)
C. 64 g二氧化硫中氧原子數和標準狀況下22.4 L一氧化碳中氧原子數
D. 20% NaOH溶液中NaOH的物質的量濃度和10% NaOH溶液中NaOH的物質的量濃度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com