
【題目】甲醇是一種重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g) +4H2(g) ΔH=akJ/mol
CO(g) +2H2(g)=CH3OH(g) ΔH=bkJ/mol
試寫出由CH4和O2制取甲醇蒸氣的熱化學方程式:____。
(2)還可以通過下列反應制備甲醇:CO(g)+2H2(g)![]() CH3OH(g)。甲圖是反應時CO和CH3OH(g)的濃度隨時間的變化情況。從反應開始到達平衡,用H2表示平均反應速率v(H2)=_______。
CH3OH(g)。甲圖是反應時CO和CH3OH(g)的濃度隨時間的變化情況。從反應開始到達平衡,用H2表示平均反應速率v(H2)=_______。
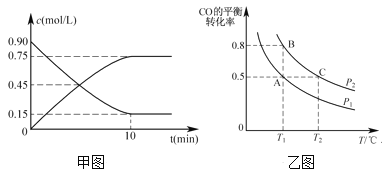
(3)在一容積可變的密閉容器中充入1 molCO和2mol H2,CO的平衡轉化率隨溫度(T)、壓強(P)的變化如乙圖所示。
①下列說法能判斷該反應達到化學平衡狀態的是____。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的體積分數不再改變
C.體系中H2的轉化率和CO的轉化率相等
D.體系中氣體的平均摩爾質量不再改變
②比較A、B兩點壓強大小PA___PB(填“>、<、=”)。
③若達到化學平衡狀態A時,容器的體積為2L。如果反應開始時仍充入1molCO和2molH2,則在平衡狀態B時容器的體積V(B)=___L。
【答案】2CH4(g) +O2(g)= 2CH3OH(g) ΔH=(a+b) kJ/mol 0.15molL-1min-1 BD < 0.4
【解析】
⑴已知2CH4(g) +O2(g)=2CO(g) +4H2(g) ΔH=akJ/mol
CO(g) +2H2(g)=CH3OH(g) ΔH=bkJ/mol
將兩個方程式相加之和,得到2CH4(g) +O2(g)= 2CH3OH(g) ΔH=(a+b) kJ/mol,故答案為2CH4(g) +O2(g)= 2CH3OH(g) ΔH=(a+b) kJ/mol;
⑵甲圖反應時CO物質的量濃度從0.90 mol/L變到0.15 mol/L,濃度改變量為0.75mol/L,H2濃度改變量為1.5 mol/L,H2的平均反應速率![]()
故答案為0.15molL-1min-1;
⑶①A選項,H2的消耗速率正向,CH3OH的生成速率正向,兩個同方向,不能作為平衡的標志,故A錯誤;
B選項,H2的體積分數不再改變,能作為判斷平衡的標志,故B正確;
C選項,體系中H2的轉化率和CO的轉化率始終相等,沒有變化,因此不能作為判斷平衡的標志,故C錯誤;
D選項,![]() ,氣體質量不變,氣體的物質的了減小,摩爾質量增大,能作為判斷平衡的標志,故D正確;
,氣體質量不變,氣體的物質的了減小,摩爾質量增大,能作為判斷平衡的標志,故D正確;
綜上所述,答案為BD;
②從A到B,轉化率變大,說明正向移動,正向為體積減小的反應,說明是加壓,即PA小于PB,故答案為<;
③A、B兩點溫度相同,壓強不同,要求B點的容器體積,則通過平衡常數不變來求,在A點:
CO(g)+ 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始量 1 mol 2 mol 0
轉化量 0.5 mol 1 mol 0.5 mol
平衡量 0.5 mol 1 mol 0.5 mol
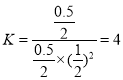
在B點,設體積為V L,
CO(g)+ 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始量 1 mol 2 mol 0
轉化量 0.8 mol 1.6 mol 0.8 mol
平衡量 0.2 mol 0.4 mol 0.8 mol
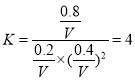
V= 0.4 L
故答案為0.4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】有鐵、氧化鐵、四氧化三鐵的混合物3.64克,加入50mL2mol/L鹽酸溶液時,恰好完全反應,并且生成氣體的體積在標準狀況下為0.224升,向所得溶液中滴加KSCN溶液無明顯變化。若將等質量的該混合物在CO中加熱并充分反應,冷卻后固體的質量為( )
A. 2 .8克 B. 1.52克 C. 3.4克 D. 2克
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個密閉容器中進行反應:2SO2(g)+O2(g)![]() 2SO3(g) 。已知反應過程中某一時刻,SO2、O2、SO3分別是2mol/L、1mol/L、2mol/L,當反應達到平衡時,可能存在的數據是( )
2SO3(g) 。已知反應過程中某一時刻,SO2、O2、SO3分別是2mol/L、1mol/L、2mol/L,當反應達到平衡時,可能存在的數據是( )
A.SO2為4mol/L,O2為2mol/LB.SO2為2.5mol/L
C.SO2、SO3均為1.5mol/LD.SO3為4mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】厭氧氨化法(Anammox)是一種新型的氨氮去除技術,下列說法中正確的是
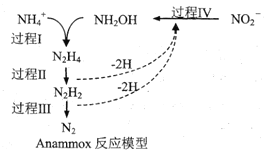
A.1molNH4+所含的質子總數為10NA(設NA為阿伏加德羅常數的值)
B.該方法每處理1molNH4+,需要0.5molNO2-
C.過程IV中,NO2-發生氧化反應
D.N2H2中含有σ鍵和π鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:2A(g)B(g)。分別取1molA于2L的固定體積的容器中,分別在T1和T2下,測得A的轉化率隨時間變化的關系曲線如圖所示。下列說法正確的是

A.升高溫度可縮短反應到達平衡的時間同時能提高A平衡的轉化率
B.從反應開始至40min時,T2溫度下生成B的物質的量比T1溫度下多
C.圖中a、b、c三點的化學反應速率依次減小
D.用B表示T1溫度下前40min的平均反應速率:v(B)=0.0025molL﹣1min﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一水合甘氨酸鋅是一種礦物類飼料添加劑,結構簡式如圖:

(1)基態Zn2+的價電子排布式為__;一水合甘氨酸鋅中所涉及的非金屬元素電負性由大到小的順序是__。
(2)甘氨酸(H2N-CH2-COOH)中N的雜化軌道類型為__;甘氨酸易溶于水,試從結構角度解釋__。
(3)一水合甘氨酸鋅中Zn2+的配位數為__。
(4)[Zn(IMI)4](ClO4)2是Zn2+的另一種配合物,IMI的結構為![]() ,則1molIMI中含有__σ鍵。
,則1molIMI中含有__σ鍵。
(5)常溫下IMI的某種衍生物與甘氨酸形成的離子化合物為液態而非固態,原因是__。

(6)Zn與S形成某種化合物的晶胞如圖Ⅰ所示。
①Zn2+填入S2-組成的__空隙中(填“四面體”或“八面體”);
②由圖不能判斷出S2-、Zn2+相切,若要使S2-、Zn2+相切,則Zn2+半徑為__pm,已知晶體密度為dg/cm3,S2-半徑為apm。(寫計算表達式)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組在實驗室選用下圖所示裝置 (夾持裝置略)采用鎂屑與液溴為原料制備無水MgBr2。
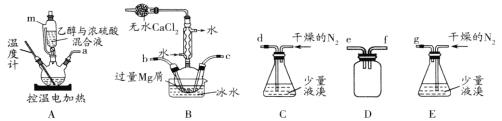
已知:①乙醚的熔點為-116.3℃,沸點為34.6℃。
②Mg和Br2反應非常劇烈,放出大量的熱;MgBr2具有強吸水性;MgBr2能與乙醚發生反應 MgBr2 +3C2H5OC2H5![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
③不考慮氮氣與鎂的反應
實驗主要步驟如下:
I.選用上述部分裝置,正確連接,檢查裝置的氣密性。向裝置中加入藥品。
II.加熱裝置A,迅速升溫至140℃,并保持140℃加熱一段時間,停止加熱。
III.通入干燥的氮氣,使溴分子緩慢進入裝置B中,直至完全加入。
IV.裝置B中反應完畢后恢復至室溫,過濾,將濾液轉移至干燥的燒瓶中,在冰水中冷卻,析出晶體,再過濾得三乙醚合溴化鎂粗產品。
V.用苯洗滌粗產品,過濾,得三乙醚合溴化鎂,將其加熱至160℃分解得無水 MgBr2。
請回答下列問題:
(1)裝置A中使用儀器m的優點是_______;
(2)步驟I中所選裝置的正確連接順序是a _____(填小寫字母),裝置D的作用是____;
(3)若加熱裝置A一段時間后發現忘記加入碎瓷片,應該采取的正確操作是________;
(4)實驗中不能用干燥空氣代替干燥N2,原因是___________;
(5)有關步驟V的說法,正確的是____;
A 可用95%的乙醇代替苯溶解粗品 B 洗滌晶體可選用0℃的苯
C 加熱至160℃的主要目的是除去苯 D 該步驟的目的是除去乙醚和可能殘留的溴
(6)為測定產品的純度(假定雜質不參與反應),可用EDTA (簡寫為Y4-,無色)標準溶液滴定,以絡黑T為指示劑(pH=6.3~11.6時顯藍色,pH>11.6時顯橙色)。已知: Mg2+與絡黑T形成的配合物(Mg2+-絡黑T)呈酒紅色,Mg2+與Y4-形成的MgY2-為無色;在pH約為9的緩沖溶液中滴定,反應的離子方程式為:Mg2+ + Y4-=MgY2-,Mg2+-絡黑T+Y4- =MgY2- +絡黑T。
①判斷滴定終點的現象為____________________;
②測定前,先稱取0.2500g無水MgBr2產品,溶解后,加人2滴絡黑T試液作指示劑,用0.0500 mol·L-1 EDTA標準溶液滴定至終點,消耗EDTA標準溶液25.00 mL,則測得無水MgBr2產品的純度是___(以質量分數表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗室模擬以粗鹽(含雜質Mg2+、Ca2+、K+和SO42-)為原料進行生產并綜合利用的某過程如下圖所示。已知: Kap[Mg(OH)2]=5.6×10-12;Kap[CaMg(CO3)2]<< Kap[Mg(OH)2]。

(1)過量試劑A是_________________________溶液。(填名稱)
(2)圖為KCI和NaCl的溶解度曲線,連續操作④是_____________________________。

(3)向濾液IV中通入NH3CO2氣體后能夠得到NaHCO3的原因是_______________(用必要的化學用語和文字說明)。
(4)已知碳酸的Ka2=5.6×10-11,次氯酸的Ka =3×10-8,工業上用飽和純堿溶液代替燒堿溶液與Cl2反應生產有效成分為次氯酸鈉的消毒液,反應的化學方程式是___________________________________。
(5)經檢測,濾液Ⅲ中c(Mg2+)<1.0×10-7 mol/L,則鎂元素最終沉淀物是_________________。
(6)⑤處母液可以生產氮肥NH4Cl,NH4Cl可用于制取具有漂白作用的三氯化氮。工業上制備NCl3的一種方法是用圖所示裝置電解,其原理是NH4Cl+2HCl![]() NC13十3H2↑。
NC13十3H2↑。

陽極反應式是___________________________________。
(7)電解氯化鈉時需要加入一定量氯化鈣,根據學習過的電解知識推測加入氯化鈣的主要作用是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是由常見元素組成的一些單質及其化合物之間的轉化關系圖。各方框表示有關的一種反應物或生成物(部分物質已經略去)。其中A、B、D在常溫下均為無色無味的氣體,C是能使濕潤的紅色石蕊試紙變藍的氣體,M是最常見的無色液體。

(1)寫出C→E的化學方程式: 。
(2)實驗室常用加熱兩種固體混合物的方法制備物質C,其化學方程式為: ,干燥C常用 (填寫試劑名稱)。
(3)E物質遇到D物質時,會觀察到 現象,若用排水法收集F,則最終集氣瓶中收集到的氣體為 (填寫物質的化學式)。
(4)寫出A→D的化學方程式: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com