
【題目】有機物X是合成某藥物的中間體,X的結構簡式為: 以有機物A為原料合成X的流程如圖所示(部分條件省略):
以有機物A為原料合成X的流程如圖所示(部分條件省略):

(1)步驟①的反應類型為____。
(2)D分子中官能團的名稱是____ 。
(3)步驟⑥中E的結構簡式為_______;碳酸鈉的作用是_________。
(4)1mol B最多可消耗H2的物質的量為______mol。
(5)利用 可制備某線性結構高分子酚醛樹脂,該反應的化學方程式為____。
可制備某線性結構高分子酚醛樹脂,該反應的化學方程式為____。
(6)滿足下列條件![]() 的同分異構體有____種。
的同分異構體有____種。
①苯環上有三個取代基;
②能發生銀鏡反應;
③能與碳酸氫鈉溶液反應放出二氧化碳。
【答案】 加成反應 (酚)羥基、酯基 ![]() 與酚羥基反應形成酚鈉 4
與酚羥基反應形成酚鈉 4 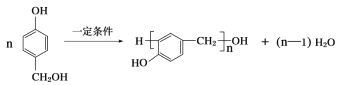 10
10
【解析】試題分析:A與甲醛反應生成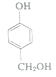 ,則A是
,則A是![]() ;
;
![]()
![]() 少了2個氫原子,所以B是
少了2個氫原子,所以B是![]() ;
;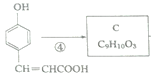 ,C多了2個氫原子,所以C是
,C多了2個氫原子,所以C是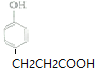 ;
;
![]() ,D是
,D是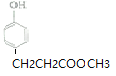 ;
;
![]()
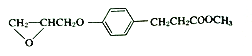 ,根據
,根據![]() ,可知E是
,可知E是![]() 。
。
解析:根據以上分析,(1) ![]() 與甲醛反應生成
與甲醛反應生成 ,反應類型為加成反應。
,反應類型為加成反應。
(2) 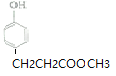 分子中官能團的名稱是酚羥基、酯基。
分子中官能團的名稱是酚羥基、酯基。
(3)步驟⑥中E的結構簡式為![]() ;碳酸鈉與酚羥基反應形成酚鈉。
;碳酸鈉與酚羥基反應形成酚鈉。
(4)1mol![]() 最多可消耗H2的物質的量為4mol。
最多可消耗H2的物質的量為4mol。
(5) 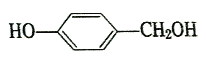 與甲醛發生縮聚反應生成高分子酚醛樹脂,該反應的化學方程式為
與甲醛發生縮聚反應生成高分子酚醛樹脂,該反應的化學方程式為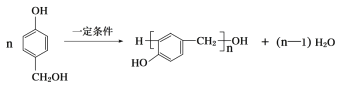 。
。
(6) ![]() 的同分異構體,①苯環上有三個取代基;②能發生銀鏡反應說明含有醛基;③能與碳酸氫鈉溶液反應放出二氧化碳,說明含有羧基;所以含有3個取代基是
的同分異構體,①苯環上有三個取代基;②能發生銀鏡反應說明含有醛基;③能與碳酸氫鈉溶液反應放出二氧化碳,說明含有羧基;所以含有3個取代基是![]() 、
、![]() ,滿足條件的有
,滿足條件的有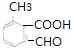 、
、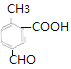 、
、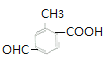 、
、 、
、 、
、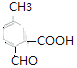 、
、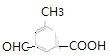 、
、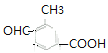 、
、 、
、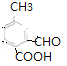 共10種。
共10種。


 高效智能課時作業系列答案
高效智能課時作業系列答案科目:高中化學 來源: 題型:
【題目】在0.2L由NaCl、MgCl2、CaCl2組成的混合溶液中,部分離子濃度大小如圖所示,回答下列問題:

(1)該混合液中,NaCl的物質的量為_____mol,含溶質MgCl2的質量為_____g。
(2)該混合液中CaCl2的物質的量為_______mol,將該混合液加水稀釋至體積為1L,稀釋后溶液中Ca2+的物質的量濃度為______mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“中國要強,中國人民生活要好,必須有強大科技。”我國下列重大科技中獲 諾貝爾獎的是( )
A | B | C | D |
|
|
|
|
蛟龍號載人潛水器 實驗成功 | 首次人工合 成結晶 牛胰島素 | 侯德榜發明聯合 制堿法 | 屠呦呦研制抗瘧新藥-青蒿素 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為將混有K2SO4、MgSO4的KNO3固體提純,并制得KNO3溶液,某學生設計了如下實驗方案:

(1).操作①為__________。
(2).操作②~④所加試劑的溶質依次為__________。
(3).如何判斷SO42-已除盡?__________。
(4).實驗過程中產生的多種沉淀__________(填“需要”或“不需要”)多次過濾,其理由是__________。
(5).該同學的實驗設計方案是否嚴密?__________(填“嚴密”或“不嚴密”),請說明理由:__________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列敘述中一定正確的是
A. 1molFe與高溫水蒸氣反應,轉移電子的數目為3NA
B. 標準狀況下,2.24LHF中含有的極性鍵數目為0.1NA
C. 5mL0.1mol/LCH3COOH溶液和10mL0.5mol/LCH3COOH溶液中所含CH3COOH分子數相等
D. 一定條件下,向0.1L容器內通入4.6gNO2氣體,NO2的物質的量濃度小于1mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】構成原電池的條件有很多,其中一種就是利用電解質的濃度差構成“濃差電池”。當電解質中某離子的濃度越大時其氧化性或還原性越強。如圖,甲池為3mol·L-1的AgNO3溶液,乙池為1mol·L-1的AgNO3溶液,A、B均為Ag電極。實驗開始先閉合K2,斷開K1,發現電流計指針發生偏轉。下列說法不正確的是

A. 一段時間后電流計指針將歸零,此時可視為反應不再進行
B. 當電流計指針歸零后,閉合K1,斷開K2后,乙池溶液濃度上升
C. 當電流計指針歸零后,閉合K1,斷開K2后,乙中Ag電極質量增加
D. 實驗開始先閉合K2,斷開K1,此時NO3-向B電極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫單質及其化合物在化工生產、污水處理等領域應用廣泛。
(1)煤制得的化工原料氣中含有羰基硫(O=C=S),該物質可轉化為H2S,主要反應如下:
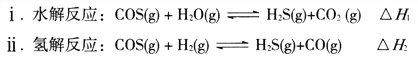
已知反應中相關的化學鍵鍵能數據如下表:
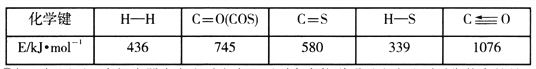
①一定條件下,密閉容器中發生反應i,其中COS(g)的平衡轉化率(![]() )與溫度(T)的關系如圖所示。則A、B、C三點對應的狀態中,v(COS)=v(H2S)的是____________。(填標號)
)與溫度(T)的關系如圖所示。則A、B、C三點對應的狀態中,v(COS)=v(H2S)的是____________。(填標號)
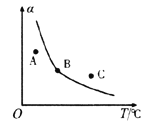
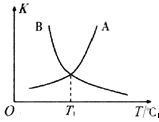
②反應ii的正、逆反應的平衡常數(K)與溫度(T)的關系如圖所示,其中表示逆反應的平衡常數(K逆)的是__________(填“A”或“B”)。T1℃時,向容積為10 L的恒容密閉容器中充入2 mol COS(g)和1 mol H2(g),發生反應ii,COS的平衡轉化率為_____________。
(2)過二硫酸是一種強氧化性酸,其結構式為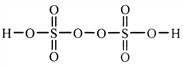
①在Ag+催化作用下,S2O82-能與Mn2+在水溶液中發生反應生成SO42-和MnO4-,該反應的離子方程式為________________________。
②工業上可用惰性電極電解硫酸和硫酸銨混合溶液的方法制備過二硫酸銨。總反應的離子方程式為________________________________。
(3)NaHS可用于污水處理的沉淀劑。已知:25℃時,反應Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常數K=1.75×1038,H2S的電離平衡常數Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常數K=1.75×1038,H2S的電離平衡常數Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的電子式為____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com