
【題目】用于汽車剎車片的聚合物Y是一種聚酰胺纖維,合成路線如下:
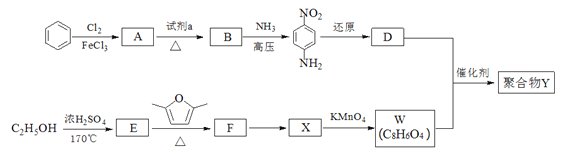
已知:①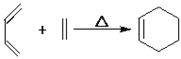
②W、D均為芳香化合物,分子中均只含兩種不同化學環境的氫原子。
(1)生成A的反應類型是______,試劑a是______,B中所含的官能團名稱是_______。
(2)①F的結構簡式是______。
②“F→X”的反應中,除X外,另外一種產物是______。
③生成聚合物Y的化學方程式是_______。
(3)Q是W的同系物且相對分子質量比W大14,則Q有_____種,其中核磁共振氫譜有4組峰,且峰面積比為1:2:2:3的為________、__________(寫結構簡式)。
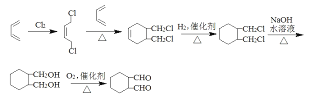
(4)只以CH2=CH-CH=CH2為有機原料,選用必要的無機試劑合成![]() ,寫出合成路線__________(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
,寫出合成路線__________(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
【答案】 取代反應 濃硝酸、濃硫酸 硝基 氯原子 ![]() H2O
H2O 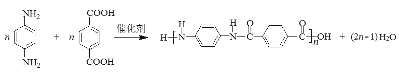 10
10 
【解析】先推理上面一行合成過程:由苯→A→B→D 的路徑觀察發現,對硝基苯胺之中的硝基缺少引入步驟。而未注明所用試劑的過程只有 A→B 一步,因此這一步是進行硝化,于是 B 應是對硝基氯苯。(1)苯與氯氣在氯化鐵催化下發生取代反應生成氯苯;反應A→B是硝化反應,試劑a為濃硝酸、濃硫酸;B是對氯硝基苯,官能團的名稱是硝基、氯原子;(2)①接下來推理下面一行。由反應知 E 是乙烯,E→F 的反應可參照信息①反應,產物 F 應為![]() ,考慮到芳香化合物 W不飽和度為 6,而分子中除苯環外有兩個碳四個氧(含兩個不飽和度),結合只含有兩種不同化學環境的氫需要的高對稱性,這兩個碳四個氧應該是兩個羧基,W 應該是對苯二甲酸。②考慮 W 是由 X 經高錳酸鉀氧化得到,而 F 中含有兩個甲基,猜測X 是對二甲苯,從而 X 化學式是 C8H10,F 化學式是 C8H12O,從而可以推測 F→X 的過程中另一種產物為水。由已知③D 為芳香化合物,分子中含有兩種不同環境的氫原子,故 D 為對苯二胺,D與W發生縮聚反應生成的聚合物Y的化學方程式是:
,考慮到芳香化合物 W不飽和度為 6,而分子中除苯環外有兩個碳四個氧(含兩個不飽和度),結合只含有兩種不同化學環境的氫需要的高對稱性,這兩個碳四個氧應該是兩個羧基,W 應該是對苯二甲酸。②考慮 W 是由 X 經高錳酸鉀氧化得到,而 F 中含有兩個甲基,猜測X 是對二甲苯,從而 X 化學式是 C8H10,F 化學式是 C8H12O,從而可以推測 F→X 的過程中另一種產物為水。由已知③D 為芳香化合物,分子中含有兩種不同環境的氫原子,故 D 為對苯二胺,D與W發生縮聚反應生成的聚合物Y的化學方程式是: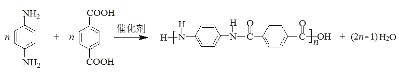 ; (3)Q是W的同系物且相對分子質量比W大14,則多一個CH2,分子中除了苯環,還有兩個羧基,碳原子還剩下一個,則若苯環上只有一個取代基則為-CH(COOH)2,結構只有一種;若有兩個取代基,則為-COOH和-CH2COOH,兩者在苯環上的位置為鄰、間、對位三種;若有三個取代基,則兩個羧基和一個甲基,先看成苯二甲酸,苯二甲酸兩個羧基的位置有鄰、間、對位,而苯環上的氫再被甲基取代的分別有2種、3種和1種;總計10種同分異構體;其中核磁共振氫譜有4組峰,且峰面積比為1:2:2:3的為
; (3)Q是W的同系物且相對分子質量比W大14,則多一個CH2,分子中除了苯環,還有兩個羧基,碳原子還剩下一個,則若苯環上只有一個取代基則為-CH(COOH)2,結構只有一種;若有兩個取代基,則為-COOH和-CH2COOH,兩者在苯環上的位置為鄰、間、對位三種;若有三個取代基,則兩個羧基和一個甲基,先看成苯二甲酸,苯二甲酸兩個羧基的位置有鄰、間、對位,而苯環上的氫再被甲基取代的分別有2種、3種和1種;總計10種同分異構體;其中核磁共振氫譜有4組峰,且峰面積比為1:2:2:3的為 ;(4)原料只有 1,3-丁二烯,因而合成六元環必須利用題中所給的信息反應;產物上下對稱,因而應該是將 1,3-丁二烯進行 1,4-加成之后再與另一分子 1,3-丁二烯反應成環;兩個醛基相隔兩個碳,因而需要 1,3-加成之后疊加水解、氧化步驟;而產物中不存在碳碳雙鍵,因而應該存在催化加氫環節,這一步必須安排在氧化生成醛基之前。具體合成流程為:
;(4)原料只有 1,3-丁二烯,因而合成六元環必須利用題中所給的信息反應;產物上下對稱,因而應該是將 1,3-丁二烯進行 1,4-加成之后再與另一分子 1,3-丁二烯反應成環;兩個醛基相隔兩個碳,因而需要 1,3-加成之后疊加水解、氧化步驟;而產物中不存在碳碳雙鍵,因而應該存在催化加氫環節,這一步必須安排在氧化生成醛基之前。具體合成流程為: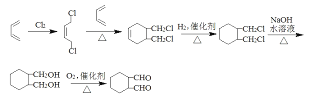 。
。


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:
【題目】芳香酸是分子中羧基與苯環直接相連的一類有機物,通常用芳香烴的氧化來制備。反應原理如下:

反應試劑、產物的物理常數:
名稱 | 相對分子質量 | 性狀 | 熔點(℃) | 沸點(℃) | 密度(g/cm3) | 水中的溶解性 |
甲苯 | 92 | 無色液體易燃易揮發 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 122 | 白色片狀或針狀晶體 | 122.4 | 248 | 1.2659 | 微溶 |
主要實驗裝置和流程如下:

實驗方法:一定量的甲苯和KMnO4溶液里于圖l 裝置中,在90℃時,反應一段時間后,
停止反應,按如下流程分離出苯甲酸并回收未反應的甲苯。

(1)白色固體B中主要成分的分子式為________。操作Ⅱ為________。
(2)如果濾液呈紫色,需加入亞硫酸氫鉀,用離子方程式表示其原因__________。
(3)下列關于儀器的組裝或者使用正確的是__________。
A.抽濾可以加快過濾速度,得到較干燥的沉淀
B.安裝電動攪拌器時,攪拌器下端不能與三頸燒瓶底、溫度計等接觸
C.如圖 回流攪拌裝置應采用直接加熱的方法
D.冷凝管中水的流向是上進下出
(4)除去殘留在苯甲酸中的甲苯應先加入______,分液,然后再向水層中加入______,抽濾,洗滌,干燥即可得到苯甲酸。
(5)純度測定:稱取2.440g產品,配成100mL溶液,取其中25.00mL 溶液,進行滴定,消耗KOH物質的量為4.5×10-3mol。產品中苯甲酸質量分數為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一種鋰釩氧化物熱電池裝置,電池總反應為xLi + LiV3O8 = Li1+xV3O8。工作時,需先引發鐵和氯酸鉀反應使共晶鹽融化。已知: LiCl-KCl共晶鹽熔點352℃。下列說法正確的是

A. 整個過程的能量轉化只涉及化學能轉化為電能
B. 放電時正極反應為:Li1+xV3O8–xe=LiV3O8+xLi+
C. 放電時Cl 移向LiV3O8電極
D. Li-Si合金熔點高于352℃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸鋰廣泛應用于化工、冶金等行業。工業上利用鋰輝石(Li2Al2Si4Ox)制備碳酸鋰的流程如下:

已知:①CaC2O4難溶于水
②Li2CO3的溶解度(g/L)
溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
請回答下列問題:
(1)鋰輝石(Li2Al2Si4Ox)可以用氧化物的形式表示其組成,形式為___________。
(2)硫酸化焙燒溫度不宜超過300℃,主要原因是___________________;焙燒中硫酸用量控制在理論用量的115%左右,硫酸加入過多的副作用是____________。
(3)“深度凈化”時,加入適量Na2C2O4的目的是__________________。
(4)“沉鋰”需要在95℃以上進行,主要原因是____________________________。
(5)工業上,將Li2CO3粗品制備成高純Li2CO3的部分工藝如下:
a.將Li2CO3溶于鹽酸作電解槽的陽極液,LiOH溶液做陰極液,兩者用離子選擇透過膜隔開,用惰性電極電解。b.電解后向LiOH溶液中加入少量NH4HCO3溶液并共熱,過濾、烘干得高純Li2CO3。
①a中,陽極的電極反應式是_________________________,宜選用_____(“陽”或“陰”)離子交換膜。
②b中,生成Li2CO3反應的化學方程式是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在t°C時,AgBr在水中的沉淀溶解平衡曲線如圖所示。又知t°C時AgCl的Ksp=4×10-10,下列說法不正確的是( )

A. 圖中a點對應的是AgBr的不飽和溶液
B. 在t °C時,AgBr的Ksp為 4.9×10-13
C. 在AgBr飽和溶液中加入NaBr固體,可使溶液由c點到b點
D. 在t °C時,AgCl(s)+Br-(aq)![]() AgBr(s)+C1- (aq)的平衡常數K≈816
AgBr(s)+C1- (aq)的平衡常數K≈816
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏伽德羅常數。下列說法正確的是
A. 標準狀況下 11.2L NT3分子中所含中子數為6.5NA
B. 電解2mol/L的NaCl溶液轉移的電子數為2 NA
C. l00mL含A13+離子數為0.4NA的Al2(SO4)3溶液的物質的量濃度為2.0molL-1
D. 常溫常壓下,7.8g苯分子中含有的碳碳雙鍵數目為0.3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的用途說法錯誤的是 ( )
A. 甲醛的水溶液(福爾馬林)可用于防腐 B. 乙二醇可用于配制汽車防凍液
C. 部分鹵代烴可用作滅火劑 D. 酚類化合物有毒,不能用于殺菌消毒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機化合物中均含有酸性雜質,除去這些雜質的方法中正確的是( )
A. 苯中含苯酚雜質:加入溴水,過濾
B. 用酸性高錳酸鉀溶液鑒別苯、環已烯和環已烷
C. 乙醛中含乙酸雜質:加入氫氧化鈉溶液洗滌,分液
D. 乙酸丁酯中含乙酸雜質:加入碳酸鈉溶液洗滌,分液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com