
【題目】利用廢鉛蓄電池的鉛泥(PbO、Pb及PbSO4等)可制備精細無機化工產品﹣3PbOPbSO4H2O (三鹽),主要制備流程如下:
(1)步驟①PbSO4轉化為難溶PbCO3的離子方程式為 .
(2)濾液1和濾液3經脫色、蒸發、結晶可得到的副產品為(寫化學式).
(3)步驟③酸溶時,其中的鉛與硝酸生成Pb(NO3)2及NO的離子方程式為;濾液2中溶質主要成分為(寫化學式).
(4)步驟⑥合成三鹽的化學方程式為 .
(5)步驟⑦洗滌操作時,檢驗沉淀是否洗滌完全的方法是 .
【答案】
(1)CO ![]() +PbSO4=PbCO3+SO
+PbSO4=PbCO3+SO ![]()
(2)Na2SO4?10H2O(或Na2SO4)
(3)3Pb+8H++2NO ![]() =3Pb+2NO↑+4H2O;HNO3
=3Pb+2NO↑+4H2O;HNO3
(4)4PbSO4+6NaOH=3Na2SO4+3PbO?PbSO4?H2O+2H2O
(5)取少量最后一次的洗滌過濾液于試管中,向其中滴加鹽酸酸化的BaCl2溶液,若不產生白色沉淀,則表明已洗滌完全
【解析】解:向鉛泥中加入Na2CO3溶液,PbSO4轉化為難溶PbCO3的離子方程式為CO ![]() +PbSO4=PbCO3+SO
+PbSO4=PbCO3+SO ![]() ,然后過濾得到濾液1為Na2SO4溶液,向濾渣中加入硝酸酸溶,PbO、Pb、PbCO3都與硝酸反應生成 Pb(NO3)2 , Pb與硝酸反應還生成NO,鉛與硝酸生成Pb(NO3)2及NO的離子方程式為3Pb+8H++2NO
,然后過濾得到濾液1為Na2SO4溶液,向濾渣中加入硝酸酸溶,PbO、Pb、PbCO3都與硝酸反應生成 Pb(NO3)2 , Pb與硝酸反應還生成NO,鉛與硝酸生成Pb(NO3)2及NO的離子方程式為3Pb+8H++2NO ![]() =3Pb+2NO↑+4H2O,然后向溶液中加入硫酸,生成bSO4沉淀,過濾,濾液2的主要成分是HNO3 , 向濾渣中加入NaOH溶液,發生反應4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O,過濾洗滌干燥得到3PbOPbSO4H2O,濾液3中含有Na2SO4 , (1)通過以上分析知,碳酸鈉和硫酸鉛發生難溶物的轉化,離子方程式為CO
=3Pb+2NO↑+4H2O,然后向溶液中加入硫酸,生成bSO4沉淀,過濾,濾液2的主要成分是HNO3 , 向濾渣中加入NaOH溶液,發生反應4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O,過濾洗滌干燥得到3PbOPbSO4H2O,濾液3中含有Na2SO4 , (1)通過以上分析知,碳酸鈉和硫酸鉛發生難溶物的轉化,離子方程式為CO ![]() +PbSO4=PbCO3+SO
+PbSO4=PbCO3+SO ![]() ,故答案為:CO32﹣+PbSO4=PbCO3+SO
,故答案為:CO32﹣+PbSO4=PbCO3+SO ![]() ;(2)通過以上分析知,濾液1和濾液3經脫色、蒸發、結晶可得到的副產品為Na2SO410H2O(或Na2SO4),故答案為:Na2SO410H2O(或Na2SO4);(3)通過以上分析知,該離子反應方程式為3Pb+8H++2NO
;(2)通過以上分析知,濾液1和濾液3經脫色、蒸發、結晶可得到的副產品為Na2SO410H2O(或Na2SO4),故答案為:Na2SO410H2O(或Na2SO4);(3)通過以上分析知,該離子反應方程式為3Pb+8H++2NO ![]() =3Pb+2NO↑+4H2O,濾液2中主要成分是未反應的HNO3 , 故答案為:3Pb+8H++2NO3﹣=3Pb+2NO↑+4H2O;HNO3;(4)該反應方程式為4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O,故答案為:4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O;(5)該沉淀吸附的離子是硫酸根離子,用鹽酸酸化的氯化鋇檢驗,其檢驗方法為取少量最后一次的洗滌過濾液于試管中,向其中滴加鹽酸酸化的BaCl2溶液,若不產生白色沉淀,則表明已洗滌完全,故答案為:取少量最后一次的洗滌過濾液于試管中,向其中滴加鹽酸酸化的BaCl2溶液,若不產生白色沉淀,則表明已洗滌完全. 向鉛泥中加入Na2CO3溶液,PbSO4轉化為難溶PbCO3的離子方程式為CO
=3Pb+2NO↑+4H2O,濾液2中主要成分是未反應的HNO3 , 故答案為:3Pb+8H++2NO3﹣=3Pb+2NO↑+4H2O;HNO3;(4)該反應方程式為4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O,故答案為:4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O;(5)該沉淀吸附的離子是硫酸根離子,用鹽酸酸化的氯化鋇檢驗,其檢驗方法為取少量最后一次的洗滌過濾液于試管中,向其中滴加鹽酸酸化的BaCl2溶液,若不產生白色沉淀,則表明已洗滌完全,故答案為:取少量最后一次的洗滌過濾液于試管中,向其中滴加鹽酸酸化的BaCl2溶液,若不產生白色沉淀,則表明已洗滌完全. 向鉛泥中加入Na2CO3溶液,PbSO4轉化為難溶PbCO3的離子方程式為CO ![]() +PbSO4=PbCO3+SO
+PbSO4=PbCO3+SO ![]() ,然后過濾得到濾液1為Na2SO4溶液,向濾渣中加入硝酸酸溶,PbO、Pb、PbCO3都與硝酸反應生成Pb(NO3)2 , Pb與硝酸反應還生成NO,鉛與硝酸生成Pb(NO3)2及NO的離子方程式為3Pb+8H++2NO
,然后過濾得到濾液1為Na2SO4溶液,向濾渣中加入硝酸酸溶,PbO、Pb、PbCO3都與硝酸反應生成Pb(NO3)2 , Pb與硝酸反應還生成NO,鉛與硝酸生成Pb(NO3)2及NO的離子方程式為3Pb+8H++2NO ![]() =3Pb+2NO↑+4H2O,然后向溶液中加入硫酸,生成bSO4沉淀,過濾,濾液2的主要成分是HNO3 , 向濾渣中加入NaOH溶液,發生反應4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O,過濾洗滌干燥得到3PbOPbSO4H2O,濾液3中含有Na2SO4 , 結合題目分析解答.
=3Pb+2NO↑+4H2O,然后向溶液中加入硫酸,生成bSO4沉淀,過濾,濾液2的主要成分是HNO3 , 向濾渣中加入NaOH溶液,發生反應4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O,過濾洗滌干燥得到3PbOPbSO4H2O,濾液3中含有Na2SO4 , 結合題目分析解答.


科目:高中化學 來源: 題型:
【題目】能正確表示下列反應的離子方程式是( )
A.濃鹽酸與鐵屑反應:2Fe+6H+═2Fe3++3H2↑
B.鈉與CuSO4溶液反應:2Na+Cu2+═Cu↓+2Na+
C.NaHCO3溶液與稀H2SO4反應:CO ![]() +2H+═H2O+CO2↑
+2H+═H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在相同溫度下,等體積等物質的量濃度的4種稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含離子種類由多到少的順序是( )
A.①=④>③=②
B.④=①>③>②
C.①>④>③>②
D.④>①=③>②
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮可形成多種氣態氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的結構式分別是 ![]() 和
和 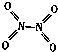 .實驗測得N﹣N鍵的鍵能為167kJmol﹣1 , NO2中氮氧鍵的鍵能為 466kJmol﹣1 , N2O4中氮氧鍵的鍵能為438.5kJmol﹣1 .
.實驗測得N﹣N鍵的鍵能為167kJmol﹣1 , NO2中氮氧鍵的鍵能為 466kJmol﹣1 , N2O4中氮氧鍵的鍵能為438.5kJmol﹣1 .
(1)寫出N2O4轉化NO2為的熱化學方程式 .
(2)對反應N2O4(g)2NO2(g),在溫度T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示.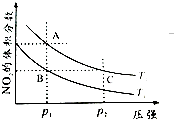
①A、C兩點的反應速率v(A)v(C)(填“>”“=”或“<”).
②B、C兩點的氣體平均相對分子質量M(B)M(C)(填“>”、“=”或“<”).
③由狀態B到達狀態A可用的方法是 .
④A點氣體的顏色比C點(填“深”、“淺”或“相同”),原因是 .
(3)在100℃時,將0.40mol的NO2氣體充入2L的密閉容器中,每隔一定時間就對該容器內的物質進行分析,得到下表所示數據.
時間/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述條件下,從反應開始直至20s時,v(NO2)=molL﹣1s﹣1 .
②若在相同的情況下最初向該容器充入的是N2O4氣體,要達到上述同樣的平衡狀態,N2O4的起始濃度應是molL﹣1 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是( )
A.將廢棄的含鉛、汞電子產品掩埋地下,防止污染環境
B.大力發展氫能源汽車減少碳排放
C.控制鹵代烴的使用,減少對臭氧層的破壞
D.大力發展核能,減少化石能源的使用,有利于保護環境
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列與金屬腐蝕有關的說法正確的是( ) 
A.圖1中,開關由M改置于N時,Cu﹣Zn合金的腐蝕速率減小
B.圖2中,Zn﹣MnO2干電池自放電腐蝕主要是由MnO2的氧化作用引起的
C.圖3中,滴加少量K3[Fe(CN)6]溶液,沒有藍色沉淀出現
D.圖4中,用犧牲鎂塊的方法來防止地下鋼鐵管道的腐蝕,鎂塊相當于原電池的正極
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com