
【題目】用下列實驗裝置進行相應實驗,能達到實驗目的的是
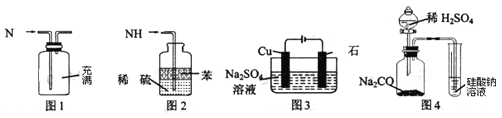
A.用圖1所示裝置可收集NO氣體
B.用圖4裝置可證明酸性:H2SO4>H2CO3>H2SiO3
C.用圖3所示裝置可實現反應:2H2O![]() O2↑+2H2↑
O2↑+2H2↑
D.用圖2所示裝置可吸收多余氨氣且能防止倒吸
 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:
【題目】![]() 時.體積均為
時.體積均為![]() 的兩個恒容密閉容器中發生可逆反應:
的兩個恒容密閉容器中發生可逆反應:![]()
![]() 實驗測得反應在起始、達到平衡時的有關數據如表,下列敘述正確的是
實驗測得反應在起始、達到平衡時的有關數據如表,下列敘述正確的是![]()
容器編號 | 起始時各物質物質的量 | 達到平衡時體系能量的變化 | ||
A | B | C | ||
| 2 | 1 | 0 |
|
|
|
|
| |
A.容器![]() 、
、![]() 中的平衡常數均為36
中的平衡常數均為36
B.向容器![]() 中通入氦氣,平衡時A的轉化率不變
中通入氦氣,平衡時A的轉化率不變
C.容器![]() 中達到平衡時放出的熱量為/span>
中達到平衡時放出的熱量為/span>![]() QkJ,達到平衡時,兩個容器中C的物質的量濃度均為
QkJ,達到平衡時,兩個容器中C的物質的量濃度均為![]()
![]()
D.其他條件不變,若容器![]() 保持恒容絕熱,則達到平衡時C的體積分數小于
保持恒容絕熱,則達到平衡時C的體積分數小于![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在溫度、初始容積相同的兩個密閉容器中,按不同方式投入反應物![]() 如圖所示
如圖所示![]() ,發生反應:
,發生反應:![]() 保持溫度不變,測得平衡時的有關數據如下:
保持溫度不變,測得平衡時的有關數據如下:
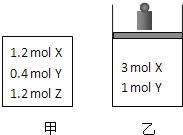
恒容容器甲 | 恒壓容器乙 | |
Y的物質的量 |
|
|
Z的體積分數 |
|
|
下列說法正確的是![]()
A.平衡時容器乙的容積一定比反應前小
B.![]()
C.![]()
D.平衡時容器甲的壓強一定比反應前大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣是一種清潔能源,又是合成氨工業的重要原料.已知氫氣有多種制取方法:
①活潑金屬![]() 如鈉、鉀
如鈉、鉀![]() 直接跟水反應;
直接跟水反應;
②金屬![]() 如鋅或鐵或鋁
如鋅或鐵或鋁![]() 跟稀鹽酸或稀硫酸反應;
跟稀鹽酸或稀硫酸反應;
③電解水制氫氣;
④由煤或焦炭跟水反應制取氫氣:![]()
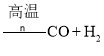 ;
;
⑤由天然氣或重油制取氫氣:![]()

![]() ;
;
(1)請你再補充一種制取氫氣的方法,寫出該反應的化學方程式 ______ .
(2)比較方法①和⑤: ______ g金屬鈉跟水反應與標準狀況下![]()
![]() 跟水反應產生氫氣的量相等.
跟水反應產生氫氣的量相等.
(3)在甲、乙、丙3個容積均為2L的密閉容器中,于相同的溫度下、使用相同的催化劑分別進行如下反應: 3H2(g)+N2(g) ![]() 2NH3(g),現按不同配比投入反應物,保持恒溫、恒容,測得反應達到平衡時有關數據如下:
2NH3(g),現按不同配比投入反應物,保持恒溫、恒容,測得反應達到平衡時有關數據如下:
容器 | 甲 | 乙 | 丙 |
反應物投入量 |
|
|
|
達到平衡的時間 |
| 5 | 8 |
| c |
| c |
|
|
|
|
混合氣體密度 |
|
|
|
①分析表數據,下列關系正確的是 ______ ![]() 填寫序號字母
填寫序號字母![]() .
.
A.![]()
![]()
![]()
②在該溫度下該反應的平衡常數![]() ______
______ ![]() 用含
用含![]() 的代數式表示
的代數式表示![]() .
.
(4)已知:![]() ;
;![]()
![]() ;
;![]()
則甲烷和![]() 反應生成
反應生成![]() 和
和![]() 的熱化學方程式為 ______ .
的熱化學方程式為 ______ .
(5)如圖所示裝置工作時均與![]() 有關.
有關.
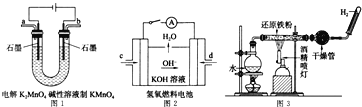
①圖1所示裝置中陽極的電極反應式為 ______ .
②圖2所示裝置中,通入![]() 的管口是 ______
的管口是 ______ ![]() 選填字母代號
選填字母代號![]() .
.
③某同學按圖3所示裝置進行實驗,實驗結束后,將玻璃管內固體物質冷卻后,溶于稀硫酸,充分反應后,滴加KSCN溶液,溶液不變紅,再滴入新制氯水,溶液變為紅色.該同學據此得出結論:鐵與水蒸氣反應生成FeO和![]() 該結論 ______
該結論 ______ ![]() 填“嚴密”或“不嚴密”
填“嚴密”或“不嚴密”![]() ,你的理由是 ______
,你的理由是 ______ ![]() 用離子方程式表示
用離子方程式表示![]() .
.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳和氮的化合物在生產生活中廣泛存在。回答下列問題:![]() 三氯化氮
三氯化氮![]() 是一種黃色、油狀、具有刺激性氣味的揮發性有毒液體,各原子均滿足8電子穩定結構。其電子式是______。氯堿工業生產時,由于食鹽水中通常含有少量
是一種黃色、油狀、具有刺激性氣味的揮發性有毒液體,各原子均滿足8電子穩定結構。其電子式是______。氯堿工業生產時,由于食鹽水中通常含有少量![]() ,而在陰極區與生成的氯氣反應產生少量
,而在陰極區與生成的氯氣反應產生少量![]() ,該反應的化學方程式為______。
,該反應的化學方程式為______。![]() 一定條件下,不同物質的量的
一定條件下,不同物質的量的![]() 與不同體積的
與不同體積的![]() 溶液充分反應放出的熱量如下表所示:
溶液充分反應放出的熱量如下表所示:
反應序號 | n | V | 放出的熱量 |
1 |
|
| A |
2 |
|
| b |
該條件![]() 與NaOH 溶液反應生成
與NaOH 溶液反應生成![]() 的熱化學反應方程式為______。
的熱化學反應方程式為______。![]() 利用CO可以將NO轉化為無害的
利用CO可以將NO轉化為無害的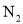 ,其反應為:
,其反應為:![]() ,向容積均為1L的甲,乙兩個恒溫
,向容積均為1L的甲,乙兩個恒溫![]() 溫度分別為
溫度分別為![]() 、
、![]() 容器中分別加入
容器中分別加入![]() 和
和![]() ,測得各容器中
,測得各容器中![]() 隨反應時間t的變化情況如下表所示:
隨反應時間t的變化情況如下表所示:
| 0 | 40 | 80 | 120 | 160 |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 甲容器中,
甲容器中,![]() 內用NO的濃度變化表示的反應速率
內用NO的濃度變化表示的反應速率![]() ______。
______。![]() 該反應的
該反應的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 甲容器反應達到平衡后,若容器內各物質的量均增加1倍,則平衡______
甲容器反應達到平衡后,若容器內各物質的量均增加1倍,則平衡______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移動。
移動。![]() 常溫下,在
常溫下,在![]() 溶液中,反應
溶液中,反應![]() 的平衡常數
的平衡常數![]() ______。
______。![]() 已知常溫下,
已知常溫下,![]() 的電離平衡常數
的電離平衡常數![]() ,
,![]() 的電離平衡常數
的電離平衡常數![]() ,
,![]()
![]() 在酸性電解質溶液中,以惰性材料作電極,將
在酸性電解質溶液中,以惰性材料作電極,將![]() 轉化為丙烯的原理如圖所示
轉化為丙烯的原理如圖所示
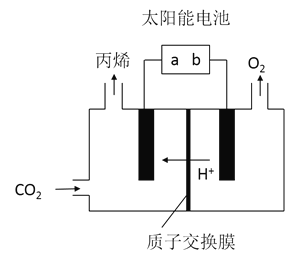
![]() 太陽能電池的負極是______
太陽能電池的負極是______![]() 填“a”或“b”
填“a”或“b”![]()
![]() 生成丙烯的電極反應式是______。
生成丙烯的電極反應式是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝酸廠常用以下方法處理尾氣:
(1)堿液吸收法:用![]() 溶液吸收
溶液吸收![]() 生成
生成![]() ,若取
,若取![]() 和足量
和足量![]() 溶液完全反應時轉移電子數為
溶液完全反應時轉移電子數為![]() ,該反應的離子方程式是______。
,該反應的離子方程式是______。
(2)氨催化吸收法,原理是![]() 與
與![]() 反應生成無毒的物質。某同學采用如圖裝置和步驟模擬工業上氮的氧化物處理過程:
反應生成無毒的物質。某同學采用如圖裝置和步驟模擬工業上氮的氧化物處理過程:
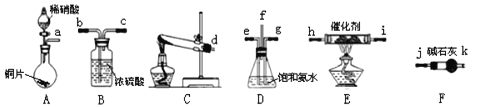
利用上述儀器,按如圖流程圖連接成模擬尾氣處理裝置:
![]()
①管口f接管口______。
②D裝置的作用是______,用飽和氨水而不用純水的目的是______。
③E裝置中發生反應的化學方程式是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中有關物質的量濃度關系正確的是
A. Na2S 溶液中 c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
B. Na2CO3溶液中:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
C. 室溫下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等體積混合,溶液中離子濃度的大小順序:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. pH=4的0.1molL﹣1NaHC2O4溶液中c(H C2O4﹣)>c(H+)>c(H2C2O4)>c(C2O42﹣)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物廣泛存在于自然界中,試回答下列問題:
(1)某處碳循環如圖所示,CaCO3轉化為HCO3-的離子方程式為_____________。

(2)常溫常壓下,空氣中的CO2溶于水,達到平衡時,無機碳在濃液中以4種形式存在,其轉化關系如下:
①CO2(g)+H2O![]() H2CO3 K=10-2.8
H2CO3 K=10-2.8
②H2CO3![]() H++HCO3- K1=10-3.5,
H++HCO3- K1=10-3.5,
③HCO3-![]() H++CO32- K2=10-10.3,
H++CO32- K2=10-10.3,
若溶液中。c(CO2)=1.0×10-5mol/L,且忽略水的電離及H2CO3的第二級電離,則溶液pH=_____。
(3)某化學小組為了測量湖水中無機碳的含量,量取 100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,將吸收液用0.10mol/L鹽酸滴定,生成的V(CO2)隨V (鹽酸)變化關系如圖2所示,則吸收液中離子濃度由大到小的順序為______________(不用寫出H+),湖水中無機碳的濃度為_______mol/L。

(4)—定條件下,CO2和H2O可以轉化為CO和H2,通過反應:CO(g)+2H2(g) ![]() CH3OH(g)制備甲醇,若起始時在密閉容器中按物質的量之比1:2充入CO和H2,測得平衡時CO轉化率a (CO)隨T、P的變化關系如圖3所示。
CH3OH(g)制備甲醇,若起始時在密閉容器中按物質的量之比1:2充入CO和H2,測得平衡時CO轉化率a (CO)隨T、P的變化關系如圖3所示。

①P1__P2(填“大于”、“小于”或“等于”);
②該反應在195℃、P2條件下達到平衡后,c(H2)=0.5 mol/L ,則該反應的平衡常數為______。
③已知CH3OH和CO的燃燒熱分別725.8kJ/mol、283.0 kJ/mol,1mol液態水變成氣態水吸熱44.0kJ,寫出甲醇不完全燃燒生成一氧化碳和氣態水的熱化學方程式:_________________。
(5)用CH3OH和O2組合形成的質子交換膜燃料電池的結構示意圖4,則c電極的反應方程式為:_______________ 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列反應的離子方程式:
(1)向Na2S2O3溶液中加入稀硫酸。_______________
(2)含有KI、H2SO4和淀粉的溶液,通入氧氣后溶液變藍__________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com