
【題目】從銀銅合金廢料中回收銀并制備銅化工產品的工藝如下:
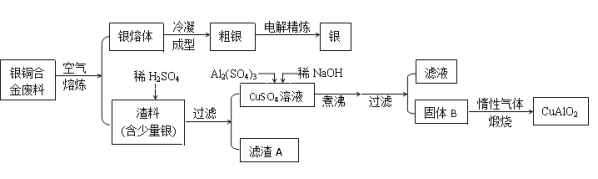
已知:①鋁元素在溶液中的存在形態與溶液pH的關系如圖所示。
②室溫時,Cu(OH)2的溶度積Ksp=2.0×10-20,當溶液中某種離子濃度小于1.0×10-5mol/L時,認為該離子沉淀完全,![]() 。
。
③Al(OH)3和Cu(OH)2開始分解的溫度分別為450℃和80℃。
請回答下列問題:
(1)電解精煉銀時,粗銀做 極(填“陰”或“陽”),電解質選用________溶液,陰極電極反應為 。
(2)在生成固體B的過程中,需控制NaOH的加入量,使溶液的pH范圍在 ,若控制不當,使NaOH過量可能會引起的反應的離子方程式為 。
(3) 煅燒過程中發生多步反應,寫出最終生成CuAlO2的反應的化學方程式: 。
(4)若銀銅合金中銅的質量分數為64%,理論上1.0 kg廢料中的銅可完全轉化為CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液 L。
【答案】
(1)陽;AgNO3;Ag++e-=Ag;
(2)6.65-12;Al(OH)3+OH-=AlO2-+2H2O;
(3)2Al2O3+4CuO=4CuAlO2+O2;(4)5;
【解析】
試題分析:(1)電鍍法精煉銀時,粗銀為陽極,精銀為陰極,硝酸銀作電解質溶液,陽極上失電子變成離子進入溶液了:Ag-e-=Ag+,陰極銀離子得到電子形成單質銀:Ag++e-=Ag,故答案為:陽;AgNO3;Ag++e-=Ag;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2,煮沸后Cu(OH)2分解產生氧化銅,可知B為Al(OH)3和CuO,在生成固體B的過程中,需控制NaOH的加入量,使溶液的pH范圍在鋁離子和銅離子全部沉淀,氫氧化鋁沉淀完全PH=12,室溫時,Cu(OH)2的溶度積Ksp=2.0×10-20.(lg5=0.7),據此計算全部沉淀的PH,c2(OH-)=![]() =2×10-15,c(H+)=10-6.65,PH=6.65,在生成固體B的過程中,需控制NaOH的加入量,使溶液的pH范圍在為:6.65-12,氫氧化鋁顯兩性能與堿反應:Al(OH)3+NaOH=NaAlO2+2H2O,反應的離子方程式為:Al(OH)3+OH-=AlO2-+2H2O,故答案為:6.65-12; Al(OH)3+OH-=AlO2-+2H2O;
=2×10-15,c(H+)=10-6.65,PH=6.65,在生成固體B的過程中,需控制NaOH的加入量,使溶液的pH范圍在為:6.65-12,氫氧化鋁顯兩性能與堿反應:Al(OH)3+NaOH=NaAlO2+2H2O,反應的離子方程式為:Al(OH)3+OH-=AlO2-+2H2O,故答案為:6.65-12; Al(OH)3+OH-=AlO2-+2H2O;
(3)反應前Cu為+2價,反應后為+1,化合價降低1,Al化合價沒有變化,所以氧元素的化合價升高,生成氧氣,反應前氧為-2價,反應后為0,化合價升高2,兩者的最小公倍數是2,再根據原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,故答案為:4CuO+2Al2O3=4CuAlO2+O2↑;
(4)由關系式:Cu~CuAlO2得n(CuAlO2)=![]() =10.0mol,則CuAlO2為10.0mol,由關系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×
=10.0mol,則CuAlO2為10.0mol,由關系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×![]() =5.0mol,所以需要體積為
=5.0mol,所以需要體積為![]() =5L,故答案為:5。
=5L,故答案為:5。


 互動英語系列答案
互動英語系列答案科目:高中化學 來源: 題型:
【題目】純鐵的熔點為1535℃,而在高爐中煉鐵時生鐵(含碳量較高的鐵的合金)在1200℃左右就熔化了,這是因為
A. 鐵的純度越高熔點越低
B. 合金的熔點比其成分物質的熔點高
C. 因為形成了鐵碳合金,所以熔點變低
D. 在高爐中熔化的過程中發生了化學反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某礦泉水標簽上印有主要的礦物質成分如下(單位為mg/L):Ca 20,K 39,Mg 3,Zn 0.06,F 0.02等,這里的 Ca,K,Mg,Zn,F是指 ( )
A. 單質 B. 元素 C. 金屬離子 D. 分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國農業因遭受酸雨而造成的損失每年高達15億元以上。為了有效控制酸雨,目前國務院已頒布了多項法規。以下各種物質哪種與酸雨的形成無關 ( )
A. SO2 B. NO C. NO2 D. CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質,前者加入后者時,無論前者是否過量,都能用同一離子方程式表示的是(還原性Fe2+> Br-> C1-) ( )
A. 稀鹽酸,碳酸鈉溶液 B. 稀鹽酸,碳酸氫鈉溶液
C. 碳酸氫鈉溶液,澄清石灰水 D. 氯水,溴化亞鐵溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】選修3——物質結構與性質
已知X、Y、Z、R、Q為周期表中原子序數依次增大的前36號元素,相關信息如下:
X元素是宇宙中最豐富的元素 |
Y元素基態原子的核外p電子數比s電子數少1 |
Z元素被譽為“太空金屬”,也有“生物金屬”之稱,其基態原子次外層有2個未成對電子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里與R元素在同一個分區 |
請回答下列問題:
(1)YX3中心原子的雜化軌道類型是 ,離子化合物YX5的電子式是 。
(2)CO與Y2屬于等電子體,1 個CO分子中含有的π鍵數目是 個。
(3)工業上利用ZO2和碳酸鋇在熔融狀態下制取化合物A(A可看做一種含氧酸鹽),A晶體的晶胞為正方體(如圖1)。
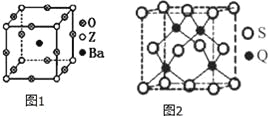
①制備A的化學反應方程式是 ;
②在A晶體中,Z的配位數為 ;
(4)R2+離子的外圍電子層電子排布式為 。R2O的熔點比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能夠形成化合物B,B晶體的晶胞為正方體(如圖2),若晶胞棱長為5.4×10-8cm,則晶胞密度為 gcm﹣3(列式并計算)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列描述中,不符合生產實際的是( )
A. 在鍍件上電鍍鋅,用鋅作陽極
B. 電解法精煉粗銅,用純銅作陰極
C. 電解飽和食鹽水制燒,用涂鎳碳鋼網作陰極
D. 電解熔融的氧化鋁制取金屬鋁,用鐵作陽極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若用乙烯和氯氣在適當的條件下反應制取四氯乙烷,這一過程中所要經歷的反應及耗用氯氣的量是(設乙烯為1mol ,反應產物中的有機物只是四氯乙烷) ( )
A. 取代,4 mol Cl2 B.加成,2 mol Cl2
C.加成、取代,2 mol Cl2 D.加成、取代,3 mol Cl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于物質的使用合理的是
A.碳酸鈉用于治療胃酸過多
B.嬰兒食品應添加著色劑,以增加嬰兒對食物的興趣
C.維生素C可防治壞血病,因而我們需要大量補充維生素C
D.藥物可以幫助我們戰勝疾病,但我們仍需合理用藥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com