
【題目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。一定條件下,向體積為1L的恒容密閉容器中充入1molCO2和3mol H2,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示。下列敘述中正確的是( )
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。一定條件下,向體積為1L的恒容密閉容器中充入1molCO2和3mol H2,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示。下列敘述中正確的是( )
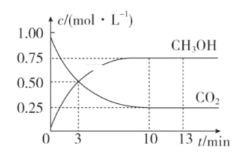
A.3min時,用CO2的濃度表示的υ(正)等于用CH3OH的濃度表示的υ(逆)
B.從0-10min,用H2表示的平均反應速率v(H2)=0.75mol·L-1·min-1
C.13min時,向容器中充入2mol氦氣,該反應的化學反應速率增加
D.從反應達到平衡狀態時,CO2的平衡轉化率為75%
 優翼小幫手同步口算系列答案
優翼小幫手同步口算系列答案科目:高中化學 來源: 題型:
【題目】已知25℃時有關弱酸的電離平衡常數:則下列有關說法正確的是( )
弱酸化學式 | CH3COOH | HCN | H2CO3 |
電離平衡常數 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
A. 等物質的量濃度的各溶液pH關系為:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. 冰醋酸中逐滴加水,則溶液的導電性、醋酸的電離程度、pH均先增大后減小
C. NaCN中通入少量CO2發生的化學反應為:NaCN+CO2+H2O=HCN+NaHCO3
D. 稀釋HCN溶液過程中,![]() 減小
減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】800℃時,在2L的密閉容器中發生反應:2NO(g)+O2(g)![]() 2NO2,n(NO)隨時間的變化如下表所示。
2NO2,n(NO)隨時間的變化如下表所示。
時間∕s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)從0~3s內,用NO表示的平均反應速率υ(NO)=_____________。
(2)圖中表示NO濃度變化的曲線是_______(填字母代號)。
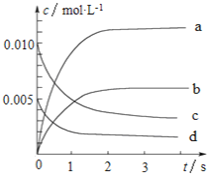
(3)達平衡時NO的轉化率為________。
(4)能說明該反應已達到平衡狀態的是_________(填序號)。
A.混合氣體的顏色保持不變
B.混合氣體的密度保持不變
C.υ逆 (NO2)=2υ正 (O2)
D.混合氣體的平均相對分子質量保持不變
(5)若升溫到850℃,達平衡后n(NO)=n(NO2),則反應向________(填“正反應方向”、“逆反應方向”)移動。
(6)若在一定條件下0.2molNO氣體與氧氣反應,達平衡時測得放出的熱量為akJ,此時NO轉化率為80%,則2molNO氣體完全反應放出的熱量為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】結合圖回答問題:如圖是中學化學中常用于混合物的分離和提純的裝置,請根據裝置回答問題:
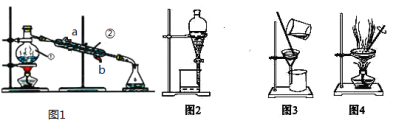
(1)寫出上述裝置中儀器的名稱:①________。
(2)若利用上述裝置分離乙酸(沸點118℃)和乙酸乙酯(沸點77.1℃)的混合物,還缺少的儀器有________,圖1中儀器 ②是從______口進水(填a或b)。
(3)圖2在分液時為使液體順利滴下,除打開活塞外,還應進行的具體操作是______
(4)從氯化鉀溶液中得到氯化鉀固體,選擇裝置______(填代表裝置圖的序號,下同);除去自來水中的Cl等雜質,選擇裝置______。
(5)實驗室常用上述裝置分離碘水中的碘,進行該操作時,需在碘水中加一試劑,在選擇試劑時,下列性質你認為哪些性質是必需的:________(填序號)。
①常溫下為液態 ②I2在其中溶解程度大 ③與水互不相容 ④密度要比水大。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上采用酸性高濃度含砷廢水(砷主要以亞砷酸H3AsO3形式存在)提取中藥藥劑As2O3。工藝流程如下:
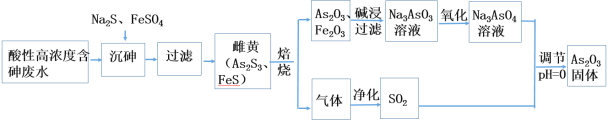
回答下列問題:
(1)已知砷元素與N同一主族,原子比N原子多兩個電子層,則砷元素的原子序數為________,“沉砷”中所用Na2S的電子式為_____________。
(2)已知:As2S3與過量的S2-存在以下反應:As2S3(s)+3S2-(aq) ![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙燒”過程中由于條件的原因,生成的三氧化二鐵中混有四氧化三鐵,證明四氧化三鐵存在的試劑是_________________________________。(寫名稱)
(4)調節pH=0時,由Na3AsO4制備As2O3的離子方程式為:_______________。
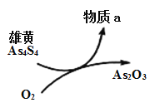
(5)一定條件下,用雄黃(As4S4)制備As2O3的轉化關系如圖所示。若反應中,1molAs4S4(其中As元素的化合價為+2價)參加反應時,轉移28mole-,則物質a為___________。(填化學式)
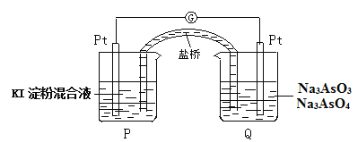
(6)某原電池裝置如圖,電池總反應為:AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。當P池中溶液由無色變成藍色時,正極上的電極反應式為____________________________。一段時間后電流計指針不發生偏轉。欲使指針偏轉方向與起始時相反,可采取的措施是____________(舉一例)。
AsO33-+I2+2OH-。當P池中溶液由無色變成藍色時,正極上的電極反應式為____________________________。一段時間后電流計指針不發生偏轉。欲使指針偏轉方向與起始時相反,可采取的措施是____________(舉一例)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃,四種水溶液① HCl ,② FeCl3 ,③ KOH ,④ Na2CO3 四種水溶液的PH依次為 4、4 、10 、10 ,各溶液中水的電離程度大小關系正確的是 ( )
A.①=②=③=④B.①>③>②>④C.④=②>③=①D.①=③>②=④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語或描述中,不正確的有
①F-的結構示意圖:![]()
②氫氧根的電子式:![]()
③HClO的結構式:H—Cl—O
④SO3的水溶液能導電,說明SO3是電解質
⑤NaHSO3在水中的電離方程式:NaHSO3=Na++H++SO32-
⑥同素異形體間的轉化和同位素間的轉化都是化學變化
A. 1項 B. 2項 C. 5項 D. 6項
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】純過氧化氫是淡藍色的黏稠液體,可與水以任意比混合,其水溶液俗稱雙氧水,為無色透明液體。實驗室常用過氧化氫制取氧氣,工業上過氧化氫是重要的氧化劑和還原劑,常用于消毒、殺菌、漂白等。某化學興趣小組的同學圍繞過氧化氫開展了調查研究與實驗,請你參與其中一起完成下列學習任務:
(1)寫出過氧化氫的電子式:_____。
(2)實驗室中用過氧化氫制取氧氣的化學方程式為____,當生成標準狀況下1.12 L O2時,轉移電子為___ mol。
(3)該興趣小組的同學查閱資料后發現H2O2為二元弱酸,其酸性比碳酸弱。請寫出H2O2在水溶液中的電離方程式:___________。
(4)同學們用0.1000 mol·L-1的酸性高錳酸鉀標準溶液滴定某試樣中過氧化氫的含量。
①寫出該反應的離子方程式____________。
②滴定到達終點的現象是____________。
③用移液管吸取25.00 mL試樣置于錐形瓶中,重復滴定四次,每次消耗的酸性KMnO4標準溶液體積如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
體積(mL) | 17.10 | 19.10 | 17.00 | 16.90 |
則試樣中過氧化氫的濃度為____mol·L-1。
④若滴定前尖嘴中有氣泡,滴定后消失,則測定結果____(填“偏低”、“偏高”或“不變”)。
(5)同學們發現向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中紅色消失。關于褪色原因:甲同學認為H2O2是二元弱酸,消耗了OH-使紅色消失;乙同學認為H2O2具有漂白性使溶液褪色。請設計一個簡單的實驗方案來判斷甲、乙兩位同學的說法是否正確___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中不屬于化合、分解、置換、復分解等四種基本反應類型的是( )
A.CuSO4+H2S=CuS↓ + H2SO4
B.2FeCl3+Cu=2FeCl2+CuCl2
C.Cu2(OH)2CO3 ![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com