
【題目】某項目學(xué)習(xí)小組在實驗失室制取漂白粉,并探究氯氣與石灰乳反應(yīng)的條件和產(chǎn)物。已知:
①二氧化錳與濃鹽酸反應(yīng)可制備氯氣,同時生成MnCl2。
②氯氣和堿的反應(yīng)為放熱反應(yīng).溫度較高時,氯氣和堿還能發(fā)生如下反應(yīng):3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。
5Cl-+ClO3-+3H2O。
該項目小組設(shè)計了下列實驗裝置,進行實驗。
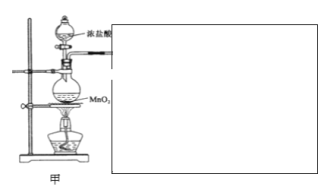
請回答下列問題:
(1)甲裝置用于制備氯氣。
①請你將裝置在圖中方框中補充完整___(并標明所加藥品)
②該項目小組用100mL12mol/L鹽酸與8.7gMnO2制備氯氣,并將所得氯氣與過量的石灰乳反應(yīng),則理論上最多可制得Ca(ClO)2的物質(zhì)的量為___。
(2)小組成員發(fā)現(xiàn),產(chǎn)物中Ca(ClO)2的質(zhì)量明顯小于理論值。他們討論后認為,原因有二:
①部分氯氣未與石灰乳反應(yīng)而逸出;
②___。
(3)為了探究反應(yīng)條件對產(chǎn)物的影響,他們另取一定量的石灰乳,緩慢勻速地通入足量氯氣,得出了ClO-、ClO3-兩種離子的物質(zhì)的量(n)與反應(yīng)時間(t)的關(guān)系曲線,粗略表示為如圖(不考慮氯氣和水的反應(yīng))。
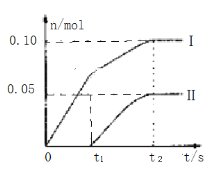
①圖中曲線I表示___離子的物質(zhì)的量隨反應(yīng)時間變化的關(guān)系。
②所取石灰乳中含有Ca(OH)2的物質(zhì)的量為___。
③另取一份與②等物質(zhì)的量的石灰乳,以較大的速率通入足量氯氣,反應(yīng)后測得產(chǎn)物中Cl-的物質(zhì)的量為0.37mol,則產(chǎn)物中![]() =___(填比值)。
=___(填比值)。
【答案】 0.05mol 氯氣與NaOH的反應(yīng)是放熱反應(yīng),溶液溫度升高,生成了Ca(ClO3)2,使產(chǎn)物中Ca(ClO)2的質(zhì)量減少 ClO- 0.25 7:6
0.05mol 氯氣與NaOH的反應(yīng)是放熱反應(yīng),溶液溫度升高,生成了Ca(ClO3)2,使產(chǎn)物中Ca(ClO)2的質(zhì)量減少 ClO- 0.25 7:6
【解析】
根據(jù)實驗原理分析裝置圖;根據(jù)反應(yīng)方程式進行相關(guān)計算;根據(jù)氧化還原反應(yīng)中電子轉(zhuǎn)移守恒及原子守恒進行相關(guān)計算。
(1)①濃鹽酸和二氧化錳反應(yīng)過程中會發(fā)出氯化氫氣體,可以通過飽和食鹽水除去Cl2中混有的HCl氣體,為了防止副反應(yīng)發(fā)生,氯氣與石灰乳的反應(yīng)可以放在冰水中進行,防止溫度升高發(fā)生副反應(yīng),氯氣有毒,所以需要用氫氧化鈉溶液進行尾氣處理,故答案為: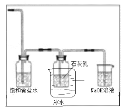
②足量的濃鹽酸與8.7g MnO2制備氯氣,并將所得氯氣與過量的石灰乳反應(yīng),則理論上最多可制得Ca(ClO)2;可以依據(jù)反應(yīng)MnO2+4HCl(濃)=MnCl2+Cl2↑+2H2O,2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,得到定量關(guān)系:8.7g MnO2物質(zhì)的量為0.1mol;2MnO2~Ca(ClO)2,n(Ca(ClO)2)=![]() n(MnO2)=
n(MnO2)=![]() ,故答案為:0.05mol;
,故答案為:0.05mol;
(2)根據(jù)題給信息知,氯氣與NaOH的反應(yīng)是放熱反應(yīng),溶液溫度升高,生成了Ca(ClO3)2,使產(chǎn)物中Ca(ClO)2的質(zhì)量減少,故答案為:氯氣與NaOH的反應(yīng)是放熱反應(yīng),溶液溫度升高,生成了Ca(ClO3)2,使產(chǎn)物中Ca(ClO)2的質(zhì)量減少;
(3)①當溫度低時,氯氣和氫氧化鈣反應(yīng)生成氯化鈣和次氯酸鈣;當溫度高時,生成氯酸鈣和氯化鈣,剛開始反應(yīng)時,溫度較低,氯氣和氫氧化鈣反應(yīng)生成氯化鈣和次氯酸鈣,所以圖2中曲線I表示離子ClO-的物質(zhì)的量隨反應(yīng)時間變化的關(guān)系,故答案為:ClO-;
②根據(jù)氧化還原反應(yīng)中得失電子數(shù)相等計算Cl-的物質(zhì)的量,設(shè)被還原的氯離子的物質(zhì)的量為n,則n×1=0.10mol×1+0.05mol×5=0.35mol,含氯離子的物質(zhì)的量為:0.35mol+0.1mol+0.05mol=0.5mol,氯化鈣、次氯酸鈣、氯酸鈣中鈣離子和含氯離子的個數(shù)比為1:2,所以所取石灰乳中含有Ca(OH)2的物質(zhì)的量為0.25mol,故答案為:0.25;
③取一份與②等物質(zhì)的量的石灰乳,物質(zhì)的量為0.25mol,根據(jù)氧化還原反應(yīng)中得失電子數(shù)相等,生成氯離子得到電子和生成次氯酸根和氯酸根失去的電子守恒,設(shè)n(ClO-)=x,n(ClO3-)=y;則得到:0.37=x×1+y×5;依據(jù)氯化鈣、次氯酸鈣、氯酸鈣中鈣離子和含氯元素的物質(zhì)的量比為1:2,得到氯元素物質(zhì)的量為0.5mol;x+y+0.37=0.5,解得:x=0.07mol,y=0.06mol,則產(chǎn)物中![]() =7:6,故答案為:7:6。
=7:6,故答案為:7:6。


 備戰(zhàn)中考寒假系列答案
備戰(zhàn)中考寒假系列答案科目:高中化學(xué) 來源: 題型:
【題目】(1)工業(yè)上制取純凈的CuCl2·2H2O的主要過程是
①將粗氧化銅(含少量Fe)溶解于稀鹽酸中,加熱、過濾,調(diào)節(jié)濾液的pH為3;
②對①所得濾液按下列步驟進行操作:
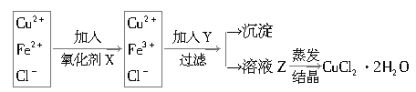
已知:
物質(zhì) | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp/25 ℃ mol3·L-3 | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀時的pH范圍 | ≥9.6 | ≥6.4 | 3~4 |
請回答下列問題:
①加入的氧化劑X,下列物質(zhì)最好選用的是 ______ .
A.KMnO4 B.H2O2 C.氯水D.HNO3
②加入Y的作用是___________________________,Y的化學(xué)式為____________。
③溶液乙在蒸發(fā)結(jié)晶時應(yīng)注意:________________________________。
(2)如圖為相互串聯(lián)的甲、乙兩個電解池,試回答下列問題:
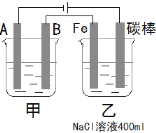
甲池若為用電解原理精煉銅的裝置,陰極增重19.2 g,則乙池陽極放出氣體在標準狀況下的體積為__________L(不考慮氣體的溶解情況)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】呋喃酚是合成農(nóng)藥的重要中間體,其合成路線如下:
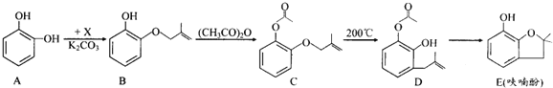
(1)A在空氣中久置會由無色轉(zhuǎn)變?yōu)樽睾稚湓蚴?/span>____________,A在核磁共振氫譜中有___________組峰。
(2)B→C的反應(yīng)類型是_____________________。
(3)已知X的分子式為C4H7Cl。寫出A→B的化學(xué)方程式:___________________。
(4)要鑒別化合物C和D,適宜的試劑是__________________________。
(5)B的同分異構(gòu)體很多,符合下列條件的有______種,寫出其中能發(fā)生銀鏡反應(yīng)的同分異構(gòu)體的結(jié)構(gòu)簡式:__________(任寫一種)。
①苯的衍生物 ②有兩個互為對位的取代基 ③含有酯基
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】已知氧化性:BrO3->IO3->Br2>I2。向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整個過程中含碘物質(zhì)的物質(zhì)的量與所加KBrO3的物質(zhì)的量的關(guān)系如圖所示。請回答下列問題:
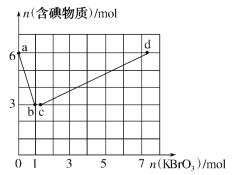
(1)b點時,KI反應(yīng)完全,則消耗的氧化劑與還原劑物質(zhì)的量之比為__,還原產(chǎn)物是__。
(2)已知b→c過程中,僅有一種元素發(fā)生化合價變化,寫出并配平該反應(yīng)的離子方程式___。
(3)①已知反應(yīng):2BrO3-+I2→2IO3-+Br2;有同學(xué)由此得出氧化性:I2>Br2的結(jié)論,你認為是否正確___,并說明理由:___。
(4)計算c→d過程中消耗KBrO3的物質(zhì)的量___。(寫出計算過程)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】一定溫度下,水溶液中H+和OH-的濃度變化曲線如圖。下列說法正確的是( )

A.升高溫度,可能引起由c向b的變化
B.該溫度下,水的離子積常數(shù)為1.0×10-13
C.該溫度下,加入FeCl3可能引起由b向a的變化
D.該溫度下,稀釋溶液可能引起由c向d的變化
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】常溫下,Ksp(CaSO4)=9×10-4,常溫下CaSO4在水中的沉淀溶解平衡曲線如圖所示。下列判斷中正確的是( )
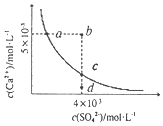
A.a、c兩點均可以表示常溫下CaSO4溶于水所形成的飽和溶液
B.向d點溶液中加入適量CaCl2固體可以變到c點
C.a點對應(yīng)的Ksp不等于c點對應(yīng)的Ksp
D.b點將有沉淀生成,平衡后溶液中c(SO42-)=3×10-3mol/L
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】下列化學(xué)用語對事實的表述正確的是
A.硬脂酸與乙醇的酯化反應(yīng):C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入過量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成離子鍵的過程:![]()
D.已知電離平衡常數(shù):H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com