
【題目】 用NA表示阿伏加德羅常數的值。下列敘述正確的是
A.1.8 g重水(D2O)中含NA個中子
B.標準狀況下,2.24 L Cl2與過量稀NaOH溶液反應,轉移的電子總數為0.2 NA
C.室溫下,21.0 g乙烯和丁烯的混合氣體中含有的碳原子數目為1.5 NA
D.足量的銅與含2 mol H2SO4的濃硫酸充分反應,可生成NA個SO2分子
 優等生題庫系列答案
優等生題庫系列答案科目:高中化學 來源: 題型:
【題目】[化學一選修55:有機化學基礎]聚戊二酸丙二醇酯(PPG)是一種可降解的聚酯類
高分子材料,在材枓的生物相容性方面有很好的應用前景。PPG的一種合成路線如下:
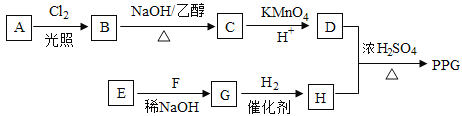
已知:
①烴A的相對分子質量為70,核磁共振氫譜顯示只有一種化學環境的氫;
②化合物B為單氯代烴:化合物C的分子式為C5H8;
③E、F為相對分子質量差14的同系物,F是福爾馬林的溶質;
④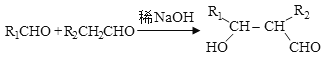 。
。
回答下列問題:
(1)A的結構簡式為 。
(2)由B生成C的化學方程式為 。
(3)由E和F生成G的反應類型為 ,G的化學名稱為 。
(4)①由D和H生成PPG的化學方程式為 。
②若PPG平均相對分子質量為10000,則其平均聚合度約為 (填標號)。
a.48 b.58 c.76 d.122
(5)D的同分異構體中能同時滿足下列條件的共有 種(不含立體異構):
①能與飽和NaHCO3溶液反應產生氣體
②既能發生銀鏡反應,又能發生皂化反應
其中核磁共振氫譜顯示為3組峰,且峰面積比為6:1:1的是(寫結構簡式) :
D的所有同分異構體在下列—種表征儀器中顯示的信號(或數據)完全相同,該儀器是_____(填標號)。
a.質譜儀 b.紅外光譜儀 c.元素分析儀 d.核磁共振儀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是 ( )。
A.CH2Cl2有 兩種結構
兩種結構
B.烯烴跟氫氣起加成反應產物是2,2,3,4-四甲基戊烷,則這樣的烯烴有3種
C. 的一氯代物有5種
的一氯代物有5種
D.1 mol某烷烴完全燃燒消耗11 mol O2,則其主鏈上含有5個碳原子的同分異構體(不考慮空間異構)有6種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在①![]() Li 、②
Li 、②![]() N 、③
N 、③![]() Na 、④
Na 、④![]() Mg 、⑤
Mg 、⑤![]() Li 、⑥
Li 、⑥![]() C 、⑦C60 、⑧石墨中,
C 、⑦C60 、⑧石墨中,
選擇序號填空。
(1) 和 質量數相等,但不能互稱同位素;
(2) 和 的中子數相等,但質子數不相等,所以不是同一種元素;
(3) 和 互為同素異形體。
(4)________和______互為同位素。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請根據官能團的不同對下列有機物進行分類。(填序號)
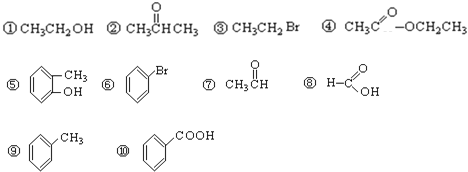
(1)芳香烴:__________; (2)鹵代烴:__________;
(3)醇:__________; (4)酚:__________;
(5)醛:__________; (6)酮:__________;
(7)羧酸:__________;(8)酯:_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘及其化合物在合成殺菌劑、藥物等方面具有廣泛用途。回答下列問題:
(1)大量的碘富集在海藻中,用水浸取后濃縮,再向濃縮液中加MnO2和H2SO4,即可得到I2,該反應的還原產物為___________;
(2)上述濃縮液中含有I-、Cl-等離子,取一定量的濃縮液,向其中滴加AgNO3溶液,當AgCl開始沉淀時,溶液中![]() 為:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
為:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反應2HI(g)![]() H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1molHI(g)分子中化學鍵斷裂時需吸收的能量為___________ kJ。
H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1molHI(g)分子中化學鍵斷裂時需吸收的能量為___________ kJ。
(4)Bodensteins研究了下列反應:2HI(g)![]() H2(g)+I2(g),在716K時,氣體混合物中碘化氫的物質的量分數x(HI)與反應時間t的關系如表:
H2(g)+I2(g),在716K時,氣體混合物中碘化氫的物質的量分數x(HI)與反應時間t的關系如表:

①根據上述實驗結果,該反應的平衡常數K的計算式為:___________;
②上述反應中,正反應速率為v正=k正x2(HI),逆反應速率為v逆=k逆x(H2)x(I2),其中k正、k逆為速率常數,則k逆為___________(以K和k正表示).若k正=0.0027min-1,在t=40min時,v正=___________min-1.
③由上述實驗數據計算得到v正~x(HI)和v逆~x(H2)的關系可用如圖表示.當升高到某一溫度時,反應重新達到平衡,相應的點分別為___________(填字母).

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、氧、磷、鐵是與生命活動密切相關的元素。回答下列問題:
(1)P的基態原子最外電子層具有的原子軌道數為 ,Fe3+比Fe2+穩定的原因是 。
(2)N、O、P三種元素第一電離能最大的是 ,電負性最大的是 。
(3)含氮化合物NH4SCN溶液是檢驗Fe3+的常用試劑,SCN-中C原子的雜化類型為 ,1mol SCN-中含π鍵的數目為 NA。
(4)某直鏈多磷酸鈉的陰離子呈如圖所示的無極單鏈狀結構,其中磷氧四面體通過共有頂角氧原子相連,則該多磷酸鈉的化學式為 。
![]()
(5)FeO、NiO的晶體結構均與氯化鈉晶體結構相同、其中Fe2+和Ni2+的離子半徑分別為7.8×10-2nm、6.9×10-2nm,則熔點FeO NiO(填“<”、“>”或“=”)原因是 。
(6)磷化硼是一種超硬耐磨的涂層材料,其晶胞結構如圖所示。P原子與B原子的最近距離為acm,則磷化硼晶胞的邊長為 cm。(用含a的代數式表示)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序數是周期數的三倍,B原子最外層電子數是內層電子數的二倍,B與A能生成化合物BA2,C與A生成化合物CA2, A的陰離子與D的陽離子電子層結構相同,都與氖原子的電子層結構相同,D 的單質與A 的單質在不同條件下反應,可生成D2A或D2A2。請回答
(1)寫出元素符號B:_________ C:_________
(2)BA2的電子式 _________ ,BA2分子中化學鍵屬于_________ 鍵。
(3)D2A2的化學式 _________ ,灼燒這化合物火焰呈_________ 色。
(4)C在元素周期表中的位置是第_________周期,_______族,其原子結構示意圖為________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖表示298K時N2與H2反應過程中的能量變化。根據右圖敘述正確的是
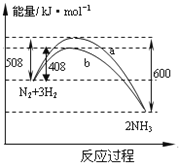
A.該反應的熱化學方程式為:1/2N2(g)+3/2H2(g)![]() NH3(g) △H=-92kJ·mol-1
NH3(g) △H=-92kJ·mol-1
B.不用催化劑,生成 1molNH3放出的熱量為46 KJ
C.加入催化劑,生成 1molNH3的反應熱減小50 KJ·mol-1
D.曲線b表明加入催化劑降低了反應熱,加快了反應速率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com