
【題目】水處理在工業生產和科學實驗中意義重大,處理方法很多,其中離子交換法最為簡單快捷,如圖是凈化過程原理。有關說法中正確的是( )
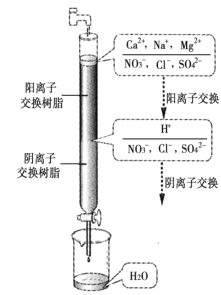
A.經過陽離子交換樹脂后,水中陽離子的總數未發生變化
B.通過陽離子交換樹脂時,H+則被交換到水中
C.通過凈化處理后,水的導電性不變
D.陽離子樹脂填充段存在反應H++OH-=H2O
【答案】B
【解析】
從圖中可以看出,在陽離子交換柱段,自來水中的Ca2+、Na+、Mg2+與陽離子交換樹脂中的H+發生交換,Ca2+、Na+、Mg2+進入陽離子交換樹脂中,樹脂中的H+進入水中;在陰離子交換柱段,NO3-、Cl-、SO42-進入陰離子交換樹脂中,樹脂中的OH-進入水中,與水中的H+反應生成H2O。
A.經過陽離子交換樹脂后,依據電荷守恒,水中陽離子的總數增多,A不正確;
B.通過陽離子交換樹脂時,水中的Ca2+、Na+、Mg2+與陽離子交換樹脂中的H+發生交換,H+則被交換到水中,B正確;
C.通過凈化處理后,水的導電性減弱,C不正確;
D.陰離子樹脂填充段存在反應H++OH-=H2O,D不正確;
故選B。


 黃岡課堂作業本系列答案
黃岡課堂作業本系列答案 單元加期末復習先鋒大考卷系列答案
單元加期末復習先鋒大考卷系列答案科目:高中化學 來源: 題型:
【題目】元素鉻(Cr)的幾種化合物存在下列轉化關系:

已知:2CrO42-+2H+![]() Cr2O72-+H2O。下列判斷不正確的是( )
Cr2O72-+H2O。下列判斷不正確的是( )
A.反應①表明Cr2O3有酸性氧化物的性質
B.反應②利用了H2O2的氧化性
C.反應③中溶液顏色變化是由化學平衡移動引起的
D.反應①②③中鉻元素的化合價均發生了變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘酸鉀(![]() )是重要的微量元素碘添加劑。實驗室設計下列實驗流程制取并測定產品中
)是重要的微量元素碘添加劑。實驗室設計下列實驗流程制取并測定產品中![]() 的純度:
的純度:
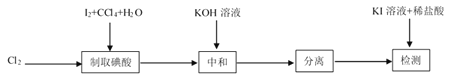
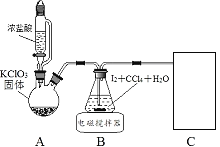
其中制取碘酸(![]() )的實驗裝置見圖,有關物質的性質列于表中
)的實驗裝置見圖,有關物質的性質列于表中
物質 | 性質 |
HIO3 | 白色固體,能溶于水,難溶于CCl4 |
KIO3 | ①白色固體,能溶于水,難溶于乙醇 ②堿性條件下易發生氧化反應:ClO-+IO3-=IO4-+Cl- |
回答下列問題
(1)裝置A中參加反應的鹽酸所表現的化學性質為______________。
(2)裝置B中反應的化學方程式為___________________ 。B中所加CCl4的作用是_________從而加快反應速率。
(3)分離出B中制得的![]() 水溶液的操作為____________;中和之前,需將HIO3溶液煮沸至接近于無色,其目的是____________,避免降低
水溶液的操作為____________;中和之前,需將HIO3溶液煮沸至接近于無色,其目的是____________,避免降低![]() 的產率。
的產率。
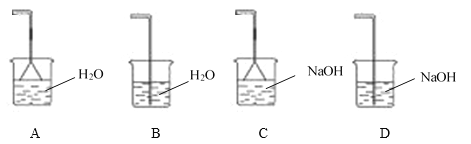
(4)為充分吸收尾氣,保護環境,C處應選用最合適的實驗裝置是____________(填序號)。
(5)為促使![]() 晶體析出,應往中和所得的
晶體析出,應往中和所得的![]() 溶液中加入適量的___________。
溶液中加入適量的___________。
(6)取1.000g![]() 產品配成200.00mL溶液,每次精確量取20.00mL溶液置于錐形瓶中,加入足量KI溶液和稀鹽酸,加入淀粉作指示劑,用0.1004mol/L
產品配成200.00mL溶液,每次精確量取20.00mL溶液置于錐形瓶中,加入足量KI溶液和稀鹽酸,加入淀粉作指示劑,用0.1004mol/L![]() 溶液滴定。滴定至終點時藍色消失(
溶液滴定。滴定至終點時藍色消失(![]() ),測得每次平均消耗
),測得每次平均消耗![]() 溶液25.00mL。則產品中
溶液25.00mL。則產品中![]() 的質量分數為___(結果保留三位有效數字)。
的質量分數為___(結果保留三位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮是地球上含量比較豐富的一種元素,氮的化合物在工業生產和生活中有重要的作用。
I.已知298K時,發生反應:N2O4(g) ![]() 2NO2(g)
2NO2(g)
(1)反應達到平衡后,壓縮容器的體積,再次達到平衡時混合氣體的顏色 ____(填“變深”、“變淺”或“不變”)。
(2)恒容密閉容器中發生上述反應,已知v正=k正·p(N2O4),v逆=k逆·p2(NO2),Kp=___________(用k正、k逆表示)。若初始壓強為100kPa,k正=2.8×104s-1,當NO2的體積分數為40%時,v正=__________kPa·s-1。[其中p(N2O4)和p(NO2)分別是N2O4和NO2的分壓,分壓=p總×氣體體積分數,k正、k逆為速率常數]
Ⅱ.在催化劑作用下,H2可以還原NO消除污染,反應為:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=akJ·mol-1
N2(g)+2H2O(g) △H=akJ·mol-1
(3)若每生成7g N2放出166kJ的熱量,則a=____。
(4)該反應分兩步進行:
①2NO(g)+H2(g)![]() N2(g)+H2O2(g) △H1
N2(g)+H2O2(g) △H1
②H2O2(g)+H2(g)![]() 2H2O(g) △H2
2H2O(g) △H2
已知:i.總反應分多步進行時,較慢的一步決定總反應速率;
III.總反應的速率表達式v=kc2(NO)·c(H2)(k為速率常數,只和溫度有關)。由上述信息可知,正反應的活化能較低的是____(填“①”或“②”)。
(5)將2molNO和1molH2充入一個恒容的密閉容器中,經相同時間測得N2的體積分數與溫度的關系如圖所示。低于900K時,N2的體積分數_____(填“是”或“不是”)對應溫度下平衡時的體積分數,原因是_____。高于900K時,N2的體積分數降低的可能原因是____。
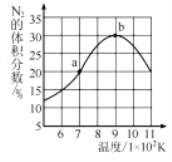
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有①Na2CO3溶液 ②NaOH固體 ③CO2 ④石墨 ⑤熔融BaCl2五種物質,按要求回答下列問題:
(1)屬于電解質的是____________(填代號,下同);屬于非電解質的是____________;能導電的是______________。
(2)上述物質中有些物質在一定條件下可以反應,請按要求寫出相應的化學方程式:
①是化合反應,也是氧化還原反應_________________________________。
②是化合反應,不是氧化還原反應_________________________________。
③是復分解反應,且有沉淀生成__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、Y、Z為常見短周期元素,三種元素分屬不同周期不同主族,且與X能形成如圖結構的化合物。已知W、Y、Z的最外層電子數之和等于X的核外電子數,W、X對應的簡單離子核外電子排布相同。下列敘述正確的是( )
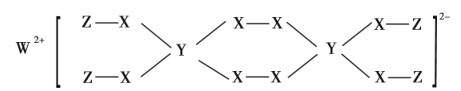
A.對應元素形成的氣態氫化物穩定性:Y>X
B.W、X對應的簡單離子半徑順序為:X>W
C.Y的氧化物對應水化物為強酸
D.該化合物中各元素均滿足8電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1840年,Devil用干燥的氯氣通過干燥的硝酸銀制得了N2O5。
(1)F.DanielS等曾利用測壓法在剛性反應器中研究了特定條件下N2O5(g)分解反應:
已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=-4.4kJmol-1
2NO2(g)=N2O4(g) ΔH2=-55.3kJmol-1
則反應N2O5(g)=2NO2(g)+![]() O2(g)的ΔH=__kJmol-1。
O2(g)的ΔH=__kJmol-1。
(2)查閱資料得知N2O5是硝酸的酸酐,常溫呈無色柱狀結晶體,微溶于冷水,可溶于熱水生成硝酸,熔點32.5℃,受熱易分解,很容易潮解,有毒。在通風櫥中進行模擬實驗制取N2O5的裝置如圖:
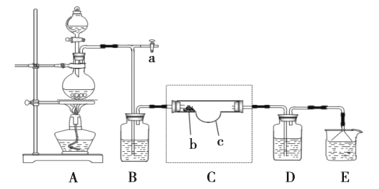
注:虛線框內為該組同學自制特殊儀器,硝酸銀放置在b處。
請回答下列問題:
①實驗開始前,需要打開a處活塞并鼓入空氣,目的是__。
②經檢驗,氯氣與硝酸銀反應的產物之一為氧氣,寫出此反應的化學反應方程式__。
③實驗時,裝置C應保持在35℃,可用的方法是__。
④能證明實驗成功制得N2O5的現象是__。
⑤裝置D中的試劑是__,作用是__。
⑥裝置E燒杯中的試劑為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
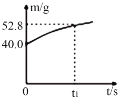
【題目】某化學興趣小組利用反應:Cu+2Fe3+=Cu2++2Fe2+設計的原電池實驗裝置如圖。請回答下列問題:
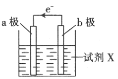
(1)b極發生___(填“氧化”或“還原”)反應,其電極材料為___,b電極反應式為:____。
(2)a極為____(填“正極”或“負極”),其電極材料可能為___,a極的電極反應式為____。
(3)該電池放電過程中,若測得電解質溶液的質量與時間的關系如圖所示,則反應從開始至t1時,電路中轉移電子的物質的量為_______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式如下,下列有關該有機物的敘述中不正確的是
![]()
A. 其分子式為 C9H10O
B. 能使酸性高錳酸鉀溶液褪色
C. 一定條件下,1mol 該有機物理論上最多能與 4mol H2 發生加成反應
D. 一定條件下,1mol 該有機物理論上最多能與 4mol Br2 發生加成反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com