
【題目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五種元素的原子序數依次遞增。已知:①
五種元素的原子序數依次遞增。已知:①![]() 位于周期表中第四周期
位于周期表中第四周期![]() 族,其余的均為短周期主族元素:②
族,其余的均為短周期主族元素:②![]() 的氧化物是光導纖維的主要成分;③
的氧化物是光導纖維的主要成分;③![]() 原子核外
原子核外![]() 層電子數為奇數;④
層電子數為奇數;④![]() 是形成化合物種類最多的元素;⑤
是形成化合物種類最多的元素;⑤![]() 原子
原子![]() 軌道的電子數為4。請回答下列問題:
軌道的電子數為4。請回答下列問題:
(1)寫出一種![]() 元素形成氫化物的化學式_____________。
元素形成氫化物的化學式_____________。
(2)在1個由![]() 與
與![]() 形成的
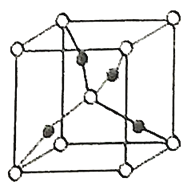
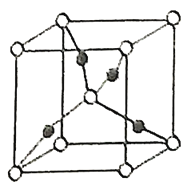
形成的![]() 晶胞中(結構如圖所示)所包含的
晶胞中(結構如圖所示)所包含的![]() 原子數目為____________個。
原子數目為____________個。
(3)在[F(NH3)4]2+離子中,![]() 的空軌道接受
的空軌道接受![]() 的氮原子提供的__________形成配位鍵。
的氮原子提供的__________形成配位鍵。
(4)常溫下![]() 、
、![]() 和氫元素按原子數目1:1:2形成的氣態常見物質
和氫元素按原子數目1:1:2形成的氣態常見物質![]() 是__________(寫名稱),
是__________(寫名稱),![]() 物質分子中
物質分子中![]() 原子軌道的雜化類型為__________,
原子軌道的雜化類型為__________,![]() 分子中
分子中![]() 鍵的數目為__________
鍵的數目為__________![]() 。
。
(5)![]() 、
、![]() 、
、![]() 三種元素的第一電離能數值由小到大的順序為__________(寫元素符號)。
三種元素的第一電離能數值由小到大的順序為__________(寫元素符號)。
【答案】CH4 4 孤電子對 甲醛 sp2雜化 3 Si<C<N
【解析】
![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五種元素的原子序數依次遞增。根據①F位于周期表中第四周期
五種元素的原子序數依次遞增。根據①F位于周期表中第四周期![]() 族可判斷其為Cu;根據②E的氧化物是光導纖維的主要成分可判斷E為Si;根據④X是形成化合物種類最多的元素可判斷X為C;根據③Y原子核外L層電子數為奇數且原子序數比X的大可判斷其屬于第二周期的元素,可能為N或F;根據⑤Z的原子P軌道的電子數為4推測出Z可能為O或S,但E的原子序數大于Z,E為Si,所以Z只能為O,處于C和O之間的Y只能為N,所以
族可判斷其為Cu;根據②E的氧化物是光導纖維的主要成分可判斷E為Si;根據④X是形成化合物種類最多的元素可判斷X為C;根據③Y原子核外L層電子數為奇數且原子序數比X的大可判斷其屬于第二周期的元素,可能為N或F;根據⑤Z的原子P軌道的電子數為4推測出Z可能為O或S,但E的原子序數大于Z,E為Si,所以Z只能為O,處于C和O之間的Y只能為N,所以![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 分別為C、N、O、Si、Cu,據此解題。
分別為C、N、O、Si、Cu,據此解題。
(1)X為C,![]() 元素形成的氫化物有很多,有烷烴、烯烴、炔烴等,其中的一種的化學式為CH4;
元素形成的氫化物有很多,有烷烴、烯烴、炔烴等,其中的一種的化學式為CH4;
(2)![]() 為Cu2O,根據化學式中原子個數比Cu:O=2:1,然后算出圖中該晶胞的黑球個數為:1×4=4,白球個數為:8×1/8+1=2,所以黑球代表的是Cu原子,白球代表的是O原子,所以該晶胞中所包含的Cu原子數目為4個;
為Cu2O,根據化學式中原子個數比Cu:O=2:1,然后算出圖中該晶胞的黑球個數為:1×4=4,白球個數為:8×1/8+1=2,所以黑球代表的是Cu原子,白球代表的是O原子,所以該晶胞中所包含的Cu原子數目為4個;
(3)在[Cu(NH3)4]2+離子中,![]() 的空軌道接受
的空軌道接受![]() 的氮原子提供的孤電子對形成配位鍵;
的氮原子提供的孤電子對形成配位鍵;
(4)常溫下C、O和氫元素按原子數目1:1:2形成的氣態常見物質![]() 是甲醛,甲醛分子中C原子可以形成四個化學鍵,因為碳的價電子數是4,其中,有兩個單電子一起與氧的兩個電子形成C=O,C剩余的兩個單電子各與兩個H形成兩個C-H鍵,雙鍵中含有一條σ鍵和一條π鍵,兩條C-H單鍵都是σ鍵,所以σ鍵數=2+1=3,雜化軌道數=σ鍵數+孤對電子數(C無孤對電子,所以孤對電子數為0),所以雜化軌道數=3,為sp2雜化,1mol HCHO分子中σ鍵的數目為3
是甲醛,甲醛分子中C原子可以形成四個化學鍵,因為碳的價電子數是4,其中,有兩個單電子一起與氧的兩個電子形成C=O,C剩余的兩個單電子各與兩個H形成兩個C-H鍵,雙鍵中含有一條σ鍵和一條π鍵,兩條C-H單鍵都是σ鍵,所以σ鍵數=2+1=3,雜化軌道數=σ鍵數+孤對電子數(C無孤對電子,所以孤對電子數為0),所以雜化軌道數=3,為sp2雜化,1mol HCHO分子中σ鍵的數目為3![]() ;
;
(5)![]() 、
、![]() 、
、![]() 三種元素分別為C、N、Si,根據每周期第一種元素電離能最小,最后一種元素的電離能最大,呈逐漸增大的趨勢;同族元素從上到下第一電離能變小來進行判斷,C、N、Si的第一電離能數值由小到大的順序為:Si<C<N。
三種元素分別為C、N、Si,根據每周期第一種元素電離能最小,最后一種元素的電離能最大,呈逐漸增大的趨勢;同族元素從上到下第一電離能變小來進行判斷,C、N、Si的第一電離能數值由小到大的順序為:Si<C<N。


科目:高中化學 來源: 題型:
【題目】加熱10.0g碳酸鈉和碳酸氫鈉的混合物至質量不再變化,剩余固體的質量為8.45g,求混合物中碳酸鈉的質量分數。( )
A. 58% B. 42% C. 36% D. 64%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年4月23日,中國人民軍成立70周年。提到海軍就不得不提航空母艦,我國正在建造第三艘航空母艦。航母的龍骨要耐沖擊,甲板要耐高溫,外殼要耐腐蝕.
(1)鎳鉻鋼抗腐蝕性能強,基態C r 原子價層電子的電子排布式為_______________。
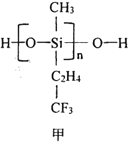
(2)航母甲板涂有一層耐高溫的材料聚硅氧烷(結構如圖申所示)。基態Si原子電子占據最高能級的電子云輪廓圖為_______形:H、C、O、Si 四種元素中的電負性最高的是______。
(3)海洋是元素的搖籃,海水中含有大量鹵族元素。
①鈦鹵化物的熔點如下表所示:
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔點/℃ | 377 | -24 | 38 | 150 |
解釋表中鹵化物之間熔點差異的原因是________________________。
②OF2的空間構型為___________,其中O原子雜化方式為__________雜化。
③氯元素可以形成多種含氧酸,其酸性由弱到強的順序為:HClO <HClO2<HClO3<HClO4。試解釋其酸性強弱的原因是_______________ 。
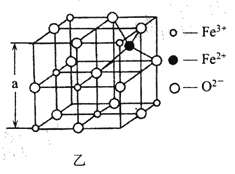
(4)海底金屬軟泥是在海洋底覆蓋著的一層紅棕色沉積物,蘊藏大著極的資源,含有硅、氧、錳、鋅等。如圖是從鐵氧體離子晶體Fe3O4 中取出的能體現其晶體結構的一個立方體。
①晶體中的氧離子是否構成了面心立方最密堆積?________(填“是”或“否”);
②已知:Fe3O4 晶體的密度為5. 18gcm -3, 根據該圖計算a________nrn (寫出計算式即可,阿伏加德羅常數的值為N A)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示是某化學興趣小組根據教材知識設計的證明Na2CO3與NaHCO3熱穩定性的套管實驗。下列敘述中不正確的是( )
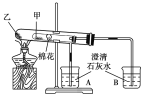
A. 甲為NaHCO3,乙為Na2CO3
B. 要證明NaHCO3受熱能產生水,可在小試管內放置沾有少量無水硫酸銅粉末的棉花球
C. 加熱不久就能看到A燒杯中的澄清石灰水變渾濁
D. 整個實驗過程中A燒杯中的澄清石灰水不會變渾濁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 在元素周期表2、3、4周期中,元素
在元素周期表2、3、4周期中,元素![]() 、
、![]() 、
、![]() 、
、![]() 與元素
與元素![]() 相鄰,已知:
相鄰,已知:![]() 元素為磷元素;
元素為磷元素;![]() 的氯化物分子呈正四面體結構:
的氯化物分子呈正四面體結構:![]() 與
與![]() 可以形成一種高溫結構陶瓷;
可以形成一種高溫結構陶瓷;![]() 的最高化合價氧化物的水化物是強酸。下列選項錯誤的是( )
的最高化合價氧化物的水化物是強酸。下列選項錯誤的是( )
A.![]() 的氧化物的晶體類型是共價晶體
的氧化物的晶體類型是共價晶體
B.![]() 的單質在空氣中廣泛存在
的單質在空氣中廣泛存在
C.![]() 和
和![]() 形成的化合物中,
形成的化合物中,![]() 可以呈現的最高化合價是
可以呈現的最高化合價是![]() 價
價
D.![]() 、
、![]() 、
、![]() 的氫化物中,沸點最低的是
的氫化物中,沸點最低的是![]() 的氫化物
的氫化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖表示實驗室某濃鹽酸試劑瓶上的標簽,試根據標簽上的有關數據回答下列問題

(1)該濃鹽酸的物質的量濃度為______mol·L-1。
(2)取用任意體積的該濃鹽酸時,下列物理量中不隨所取體積的多少而變化的是_______(填字母代號)。
A.溶液中HCl的物質的量 B.溶液的濃度
C.溶液中Cl-的數目 D.溶液的密度
(3)某學生欲用上述濃鹽酸和蒸餾水配制480 mL物質的量濃度為0.400 mol·L-1的稀鹽酸。
①該學生需要量取_________mL(保留一位小數)上述濃鹽酸進行配制。如果實驗室有5mL、10mL、50mL量筒,應選用___________mL量筒最好。
②配制時所需儀器除了量筒、燒杯、玻璃棒外,還需要的儀器有:___________。
③下列情況會導致所配溶液的濃度偏低的是__________(填字母代號)。
A.濃鹽酸揮發,濃度不足
B.配制前容量瓶中有少量的水
C.配制溶液時,俯視容量瓶刻度線
D.加水時超過刻度線,用膠頭滴管吸出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是一種優良的消毒劑,濃度過高時易發生分解,為了運輸和貯存便利常將其制成
是一種優良的消毒劑,濃度過高時易發生分解,為了運輸和貯存便利常將其制成![]() 固體,模擬工業上用過氧化氫法制備
固體,模擬工業上用過氧化氫法制備![]() 固體的實驗裝置如圖所示。
固體的實驗裝置如圖所示。
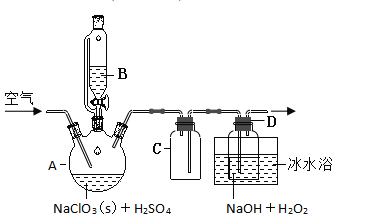
已知:![]() 熔點-59℃、沸點11℃、
熔點-59℃、沸點11℃、![]() 沸點150℃
沸點150℃
![]() 中的化學方程式:
中的化學方程式:![]()
(1)![]() 放入儀器
放入儀器![]() 中,儀器
中,儀器![]() 中的藥品是__________(寫化學式)。如果儀器
中的藥品是__________(寫化學式)。如果儀器![]() 改成分液漏斗,實驗過程中可能會出現的實驗現象__________。
改成分液漏斗,實驗過程中可能會出現的實驗現象__________。
(2)![]() 裝置有明顯缺陷,請繪出合理的裝置圖(標明氣流方向)__________。
裝置有明顯缺陷,請繪出合理的裝置圖(標明氣流方向)__________。
(3)向![]() 裝置中通入空氣,其作用是趕出
裝置中通入空氣,其作用是趕出![]() ,然后通過
,然后通過![]() 再到
再到![]() 中反應。通空氣不能過快的原因是__________,通空氣也不能過慢原因是__________。
中反應。通空氣不能過快的原因是__________,通空氣也不能過慢原因是__________。
(4)冰水浴冷卻的目的是__________。
a.降低![]() 的溶解度 b.減少
的溶解度 b.減少![]() 的分解 c.使
的分解 c.使![]() 變為液態 d.加快反應速率
變為液態 d.加快反應速率
(5)寫出![]() 中發生反應的化學方程式__________,
中發生反應的化學方程式__________,![]() 在反應起到__________作用。假設在反應中消耗掉
在反應起到__________作用。假設在反應中消耗掉![]() 則有__________
則有__________![]() 電子轉移。
電子轉移。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲用98%的濃硫酸(密度為1.84g·cm-3)配制成濃度為0.5mol·L-1的稀硫酸480mL。
(1)選用的主要儀器有:量筒、玻璃棒、膠頭滴管、燒杯、_______。
(2)請將下列各操作,按正確的序號填在橫線上。
A.用量筒量取濃H2SO4 B.反復顛倒搖勻
C.用膠頭滴管加蒸餾水至刻度線 D.洗凈所用儀器
E.稀釋濃H2SO4 F.將溶液轉入容量瓶
其操作正確的順序依次為_______。
(3)簡要回答下列問題:
①所需濃硫酸的體積為_______mL。
②如果實驗室有15mL、20mL、50mL的量筒應選用_____mL的量筒最好,量取時發現量筒不干凈用水洗凈后直接量取將使濃度____(“偏高”、“偏低”、“無影響”)。
③將濃硫酸沿燒杯內壁慢慢注入盛水的燒杯中,并用玻璃棒不斷攪拌的目的是_____,若攪拌過程中有液體濺出結果會使濃度偏______。
④在轉入容量瓶前燒杯中液體應______,否則會使濃度偏_______;并洗滌燒杯和玻璃棒2~3次,洗滌液也要轉入容量瓶,否則會使濃度_______。
⑤定容時必須使溶液凹液面與刻度線相切,若俯視會使濃度_____;仰視則使濃度______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圍繞下列幾種物質:①鋁、②Al2O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固體、⑥稀氨水、⑦Al2(SO4)3、⑧NaOH溶液、⑨NaHCO3溶液,按要求回答下列問題:
(1)既能與強酸反應,又能與強堿反應的是_____________(填序號);
(2)屬于電解質的是_____________(填序號);
(3)寫出最適宜制取Al(OH)3的離子方程式_____________;
(4)兩物質間發生反應的離子方程式為H++OH-=H2O,請寫出該反應的化學方程式_____________;
(5)寫出①和⑧反應的離子方程式________________________;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com