
【題目】在體積為V L的恒容密閉容器中盛有一定量H2,通入Br2(g)發生反應H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。當溫度分別為T1、T2,平衡時,H2的體積分數與Br2(g)的物質的量變化關系如圖所示。下列說法正確的是
2HBr(g);ΔH<0。當溫度分別為T1、T2,平衡時,H2的體積分數與Br2(g)的物質的量變化關系如圖所示。下列說法正確的是
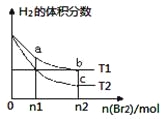
A. 若b、c點的平衡常數分別為K1、K2,則K1>K2
B. a、b兩點的反應速率:b>a
C. 為了提高Br2(g)的轉化率,可采取增加Br2(g)通入量的方法
D. 若平衡后保持溫度不變,壓縮容器體積平衡一定不移動
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵是一種重要的化工原料,可以制備一系列物質(如圖所示)。下列說法錯誤的是
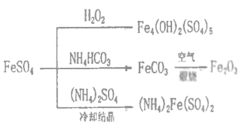
A.FeCO3轉化為鐵紅的化學方程式:4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
B.常溫下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小
C.制備Fe4(OH)2(SO4)5、Fe2O3、(NH4)2Fe(SO4)2的過程都發生了氧化還原反應
D.為防止NH4HCO3分解,生產FeCO3需在較低溫度下進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.橙紅色化合物A由五種元素組成,其中一種元素為原子半徑最大的短周期元素(稀有氣體元素除外),按如圖流程進行實驗。氣體B為純凈物,能使濕潤的紅色石蕊試紙變藍,溶液C呈黃色,沉淀D為磚紅色沉淀。
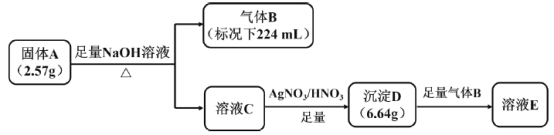
請回答:
(1)組成A的金屬元素是___________(填元素符號),A的化學式是___________。
(2)沉淀D與足量B反應的離子反應方程式____________。
(3)A中的某種金屬元素對應的單質可以通過鋁熱反應制備,寫出化學反應方程式________。
II.某興趣小組為了探究84消毒液(主要成分NaClO)和酒精混合使用是否存在安全隱患,利用如圖裝置進行實驗。
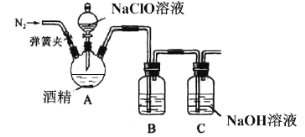
請回答:
(1)三頸燒瓶中出現黃綠色氣體,請寫出相應的化學方程式__________。(乙醇被氧化為乙醛)
(2)有同學用手觸碰三頸燒瓶后發現,反應一段時間后裝置溫度升高,所以提出產生的氣體中可能混有O2,請用離子方程式解釋__________,該同學為了驗證O2,打開彈簧夾,用帶火星的木條檢驗,該操作的錯誤為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】飛秒(1fs=10-15s)化學廣泛應用于化學研究。大多雙分子反應難于確定反應歷程,Zewail通過研究HI與CO2反應巧妙的解決了這個問題,其反應過程中的片斷:![]() (1ps=1000fs)。下列說法不正確的是
(1ps=1000fs)。下列說法不正確的是
A.反應過程中CO2未全部斷鍵而HI全部斷鍵
B.HOCO是HI與CO2雙分子反應的過渡態產物
C.觀察到HOCO解離需用1ps,說明HI與CO2反應極快
D.該反應的起點是HI的解離,終點是OH自由基與I自由基的結合
查看答案和解析>>
科目:高中化學 來源: 題型:
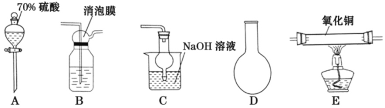
【題目】已知Cu2O在酸性條件下易歧化且2Cu2++4I-=2CuI↓+I2;碘單質易溶于碘化鉀形成I3—,I3—極易被碘化亞銅吸附。請搭建合適的裝置制備二氧化硫并定性與定量的探究其與氧化銅反應的產物。
(一)探究二氧化硫與氧化銅反應
(1)下列儀器按連接順序排列(填寫代表儀器的字母,不考慮夾持和橡皮管連接):A-D-____。
(2)裝置B使用消泡膜的目的是____。
(3)充分反應后,硬質玻璃管中黑色固體變紅色,取產物少許,加水后部分固體溶解,溶液呈藍色,過濾紅色沉淀物洗滌干凈后,加硫酸溶解后溶液也呈藍色且仍有少量紅色難溶物。寫出硬質玻璃管中發生的化學方程式____。
(二)碘量法測定硫酸銅的質量分數。
步驟1:配制并標定Na2S2O3標準溶液,其濃度為a molL—1。
步驟2:取硬質玻璃管產物mg配制為250mL溶液。(Cu2O不溶于水,已過濾掉)
步驟3:取20.00mL溶液,滴加幾滴硫酸溶液并加入過量碘化鉀溶液,以淀粉溶液作指示劑用硫代硫酸鈉標準溶液滴定,消耗體積為VmL,接近終點時加入了硫氰化鉀溶液。(I2+2Na2S2O3=Na2S4O6+2NaI)
(4)Na2S2O3溶液需要標定的原因是____,配制該溶液時需要用到的玻璃儀器有試劑瓶、燒杯、____和玻璃棒。
(5)通過上述測定產物中硫酸銅質量分數為____(用含字母的代數式表示),該測定值比實際值____(填“偏小”或“偏大”),原因是____,加入了硫氰化鉀溶液的原因可能是____,從而減少實驗誤差。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅—空氣燃料電池有比能量高、容量大、使用壽命長等優點,可用作電動車動力電源,電池的電解質溶液為 KOH 溶液,放電時發生反應:2Zn + O2+4OH-+2H2O= 2[Zn(OH)4]2-。下列說法正確的是:
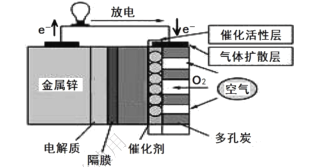
A.放電時,負極反應為 Zn-2e- = Zn2+
B.該隔膜為陽離子交換膜,允許K+通過
C.充電時,當 0.1 molO2 生成時,流經電解質溶液的電子個數約為 1.204×1022
D.采用多孔炭可提高電極與電解質溶液的接觸面積,并有利于氧氣擴散至電極表面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫 25 ℃下,向一定量的 0.1 molL-1 的 MOH 溶液中逐滴滴入稀鹽酸。溶液中水電離出的氫離子濃度的負對數[用 pC 表示,pC=-lgc(H+)水]與加入鹽酸體積的關系如圖所示。下列敘述錯誤的是:
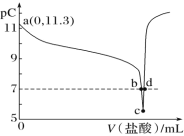
A.MOH 為弱堿,且 Kb 的數量級為![]()
B.隨著稀鹽酸的加入,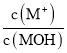 不斷減小
不斷減小
C.b 點溶液呈中性
D.c 點溶液中水的電離程度最大,且![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,反應H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常數K=
H2O(g)+CO(g)的平衡常數K=![]() 。該溫度下,在甲、乙、丙三個恒容密閉容器中,投入H2(g)和CO2(g),其起始濃度如表所示:
。該溫度下,在甲、乙、丙三個恒容密閉容器中,投入H2(g)和CO2(g),其起始濃度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判斷不正確的是( )
A. 反應開始時,丙容器中化學反應速率最大,甲容器中化學反應速率最小
B. 平衡時,乙容器中CO2的轉化率大于60%
C. 平衡時,甲容器中和丙容器中H2的轉化率均是60%
D. 平衡時,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知298K時,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲線如圖所示(圖中R表示Ni或Fe),下列說法正確的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )
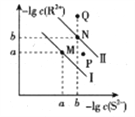
A. M點對應的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 與P點相對應的NiS的分散系是均一穩定的
C. 向Q點對應的溶液中加水,可轉化成N點對應的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常數K=6000
NiS+Fe2+的平衡常數K=6000
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com