
【題目】游離態的氮經一系列轉化可以得到硝酸,如下圖所示。

(1)NH3和O2在催化劑作用下反應,其化學方程式是______________。
(2)NO2→HNO3反應中氧化劑和還原劑的物質的量之比為________________。
(3)2NO(g)+O2(g) ![]() 2NO2(g)是制造硝酸的重要反應之一。在800℃時,向容積為1L的密閉容器中充入0.010molNO和0.005molO2,反應過程中NO的濃度隨時間變化如下圖所示。
2NO2(g)是制造硝酸的重要反應之一。在800℃時,向容積為1L的密閉容器中充入0.010molNO和0.005molO2,反應過程中NO的濃度隨時間變化如下圖所示。

①2min內,v(O2)=________mol/(L·min)
②800℃時,該反應的化學平衡常數為__________。
③判斷該反應達到平衡的依據是(寫出2條即可)____________。
④已知:ⅰ.
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,寫出NO生成NO2熱化學方程式_____________,溫度對于NO生成NO2平衡轉化率的影響是:___________________。
(4)電解法處理含氮氧化物廢氣,可以回收硝酸。實驗室模擬電解法吸收NO,裝置如圖所示(均為石墨電極)。請寫出電極過程中NO轉化為硝酸的電極反應式:______________。

【答案】 4NH3 + 5O2 ![]() 4NO + 6H2O 1:2 1.25×10-3 400 體系壓強不變、各物質濃度不變、各物質體積分數不變等等。 2NO(g)+O2(g)
4NO + 6H2O 1:2 1.25×10-3 400 體系壓強不變、各物質濃度不變、各物質體積分數不變等等。 2NO(g)+O2(g) ![]() 2NO2(g) ΔH = -115 kJ·mol-1。 溫度升高,平衡向逆反應方向移動,NO轉化為NO2的平衡轉化率降低 NO-3e- + 2H2O === NO3- + 4H+
2NO2(g) ΔH = -115 kJ·mol-1。 溫度升高,平衡向逆反應方向移動,NO轉化為NO2的平衡轉化率降低 NO-3e- + 2H2O === NO3- + 4H+
【解析】(1)NH3和O2在催化劑作用下反應生成一氧化氮和水,反應的化學方程式為4NH3 + 5O2 ![]() 4NO + 6H2O;(2)NO2溶于水生成硝酸和NO:3NO2+H2O=2HNO3+NO,其中NO是還原產物,硝酸是氧化產物,則反應中氧化劑和還原劑的物質的量之比為1:2;(3)①由圖象可知用NO濃度的變化計算反應速率 v(NO)=(0.010mol/L0.005mol/L)/2min=0.025mol/(Lmin),則v(O2)=1/2v(NO)=1.25×10-3mol/(Lmin);②
4NO + 6H2O;(2)NO2溶于水生成硝酸和NO:3NO2+H2O=2HNO3+NO,其中NO是還原產物,硝酸是氧化產物,則反應中氧化劑和還原劑的物質的量之比為1:2;(3)①由圖象可知用NO濃度的變化計算反應速率 v(NO)=(0.010mol/L0.005mol/L)/2min=0.025mol/(Lmin),則v(O2)=1/2v(NO)=1.25×10-3mol/(Lmin);②
2NO(g)+O2(g)2NO2(g)
起始濃度(mol/L) 0.01 0.005 0
平衡濃度(mol/L) 0.005 0.0025 0.005
則k=c2(NO2)/c2(NO)·c(O2)=0.0052/0.0052×0.0025=400;
③在一定條件下,當可逆反應的正反應速率和逆反應速率相等時(但不為0),反應體系中各種物質的濃度或含量不再發生變化的狀態,稱為化學平衡狀態。該反應是體積減小的可逆反應,所以判斷該反應達到平衡的依據有:體系壓強不變、各物質濃度不變、各物質體積分數不變等。④i.N2(g)+O2(g)=2NO(g)△H=(945kJ/mol+498kJ/mol)-2×630kJ/mol=+183kJ/mol,ii.N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,則蓋斯定律ii-i得到2NO(g)+O2(g)=2NO2(g)△H=-115 kJ/mol。溫度升高,平衡向逆反應方向移動,NO轉化為NO2的平衡轉化率降低;(4)電解過程中NO在陽極失去電子轉化為硝酸的電極反應式為NO-3e- +2H2O=NO3- + 4H+。


科目:高中化學 來源: 題型:
【題目】氯的含氧酸根離子有 ClO-、 ClO2- 、 ClO3-、 ClO4- 等,關于它們的說法不正確的是( )
A. ClO4-是 sp3 雜化 B. ClO3- 的空間構型為三角錐形
C. ClO2-的空間構型為直線形 D. ClO- 中 Cl 顯+1 價
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列屬于吸熱反應是
A. 金屬鈉與水的反應 B. 鹽酸與氫氧化鈉的反應
C. 鋁與氧化鐵的鋁熱反應 D. NH4Cl晶體與Ba(OH)2·8H2O晶體反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸鈉、碳酸氫鈉是日常生產生活中常用的兩種鹽。在實驗室中制取NaHCO3的方法有多種。請
依據下列方法回答問題:
方法一:模擬工業“侯氏制堿法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO↓+NH4Cl)
第一步:連接好裝置,檢驗氣密性,在儀器內裝人藥品。
第二步:讓某一裝置先發生反應,直到產生的氣體不能再在Ⅲ中溶解,再通入另一裝置中產生的氣體,片刻后,Ⅲ中出現固體。繼續向Ⅲ中通入兩種氣體,直到不再有固體產生。
第三步:分離Ⅲ中所得的混合物,得到NaHCO3固體。
第四步:向濾液中加入適量的某固體粉末,有NH4Cl晶體析出。

(1)圖中所示裝置的連接順序是:a接f;e接________;b接_________(填接口編號)。
(2) I中盛放稀鹽酸的儀器名稱是_____________,IV中應選用的液體為________________。
(3 )第二步中讓 _____________ (填序號)裝置先發生反應。
(4)第四步中所加固體粉末為________。所得的晶體中常含有少置的NaCl和NaHCO3(約占5%~8%),請設計一個簡單的實驗,不使用其他任何試劑,證明所得晶體大部分是NH4Cl。簡要寫出操作和現象______________________。
方法二:把CO2通人飽和Na2CO3溶液制取NaHCO3。裝置如下圖所示(氣密性已檢驗,部分夾持裝置略):

(5 )請結合化學平衡移動原理解釋B中溶液的作用_________________。
(6)當C中有大量白色固體析出時,停止實驗,將固體過濾、洗滌、干燥備用。為確定固體的成分,實驗小組設計方案如下(取一定量的固體,配成溶液作為樣液,其余固體備用):
①方案1:取樣液與澄清的Ca(OH)2溶液混合,出現白色沉淀。
實驗小組對現象產生的原理進行分析,認為該方案不合理,理由是________________。
②方案2:取樣液與BaCl2溶液混合,出現白色沉淀并有氣體產生。
實驗小組認為固體中存在NaHCO3,其離子方程式是________________。
方法三:(7)請你再寫出一種實驗室制取少量碳酸氫鈉的方法(用相關的化學反應方程式來表示):__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙連個探究性學習小組,他們擬測定過氧化鈉樣品(含少量的Na2O)的純度。
(1)甲組同學擬選用圖l實驗裝置完成實驗:

①寫出實驗中所發生主要反應的化學方程式____________
②該組同學必須選用的裝置的連接順序是:
A 接(____),(____)接(____), (____)接(____) (填接口字母,可不填滿);
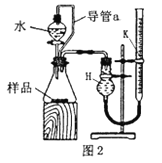
(2)乙組同學仔細分析甲組同學的實驗裝置后,認為:水滴入錐形瓶中,即使不生成氧氣,也會將瓶內空氣排出,使所測氧氣體積偏大;實驗結束時,連接廣口瓶和量筒的導管中有少量水存在,使所測氧氣體積偏小。于是他們設計了圖2所示的實驗裝置。
①裝置中導管a的作用:__________
②實驗結束冷卻至室溫后,在讀取量氣管k中液面讀數時,K中液面高于H中的液面,則測量結果將__________(偏高,不變或偏低),若有影響,應進行_________(操作)后再讀效;
③若實驗中樣品的質量為mg,實驗前后量氣管k中液面讀數分別為V0L、V1L(V0> V1換算成標況)。則樣品的純度為__________(含m、V0、V1的表達式)
(3)圖2的裝置可測定一定質量銅鐵合金(不含其它元素)樣品中鐵的質量分數。分液漏斗中加入的試劑是__________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.1mol任何物質的體積都約是22.4L
B.1molH2所占的體積約是22.4L
C.1molH2和1mol H2O所含的分子數相同
D.16gN2和16gO2所含的分子數相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂在工業、醫療等領域均有重要用途。某化學小組利用硼砂工廠的固體廢棄物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),設計了回收其中鎂的工藝流程:

(1)酸浸前,將固體廢棄物研磨的目的是_______,為達到此目的,還可以采取的措施是_____(任寫一條)。
(2)酸浸時,生成濾渣I的離子方程式為_________。
(3)第一次調節pH的目的是_____。當加入氨水使Al3+開始沉淀時,溶液中c(Fe3+)/c(Al3+)為 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)設計簡單方案分離濾渣2,簡述實驗過程:______。
(5)濾液3中可回收利用的物質主要是_____(填化學式),其陽離子的電子式為 _______。
(6)寫出工業上從濾渣3中獲得鎂錠的所有反應的化學方程式:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】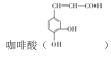 是制備某種抗腫瘤藥物的重要原料。由甲苯制備咖啡酸的合成路線(部分反應條件略去)如圖所示:
是制備某種抗腫瘤藥物的重要原料。由甲苯制備咖啡酸的合成路線(部分反應條件略去)如圖所示:

已知:
(1)咖啡酸的分子式為_____,含氧官能團有______。
(2)A的結構簡式為_____,該分子的核磁共振氫譜峰面積之比為______。
(3)反應④的化學方程式為________,反應類型為_______。
(4)滿足下列條件的咖啡酸的同分異構體有_____種。
①苯環上有三個取代基②1mol該物質能與2molNaHCO3反應。
(5)檢驗F中碳碳雙鍵官能團的方法是_______。
(6)苯丙烯酸的結構簡式為![]() ,根據提供信息ii,設計以甲苯和乙醛為原料制備苯丙烯酸的合成路線。_______
,根據提供信息ii,設計以甲苯和乙醛為原料制備苯丙烯酸的合成路線。_______
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com