
【題目】1000mL某待測液中除含有0.2mol.L-1的Na+外,還可能含有下列離子中的一種或多種:
陽離子 | K+、NH4+、Fe3+、Ba2+ |
陰離子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
現進行如下實驗操作(每次實驗所加試劑均過量):

(1)寫出生成白色沉淀B的離子方程式: 。
(2)待測液中肯定不存在的陽離子是 。
(3)若無色氣體D是單一氣體:
陰離子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42-11777437 |
濃度/mol.L — |
①將陰離子的物質的量濃度填入上表中(一定不存在的填“0”,不能確定的填“?”):
②判斷原溶液中K+是否存在,若存在,求其物質的量濃度的最小值,若不存在,請說明理由: 。
(4)若無色氣體D是混合氣體:
①待測液中一定含有的陰離子是 。
②沉淀A中能與稀硝酸反應的成分是 (寫化學式)。
【答案】(1)HCO3-+Ba2++OH-=BaCO3↓+H2O;(2)Fe3+、Ba2+;
(3)①
陰離子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
濃度/mol·L- | ? | 0.1 | 0.1 | 0 | 0.05 |
②根據電荷守恒,c(K+)最小濃度是(0.4-0.3)mol·L-1=0.1mol·L-1;因此:存在;K+離子最小濃度為0.1mol·L-1;(4)①CO32-、HCO3-、SO32-;②BaCO3、BaSO3。
【解析】
試題分析:加入BaCl2溶液得到沉淀A,沉淀A可能是BaCO3,也可能是BaSO3,也可能是BaSO4或者是它們的混合物,根據離子守恒,原溶液一定不存在Ba2+,加入氫氧化鈉溶液出現氣體,此氣體為NH3,溶液中存在NH4+,根據N元素守恒,n(NH4+)=n(NH3)=2.24L÷22.4L/mol=0.1mol,生成白色沉淀,此沉淀是BaCO3,發生的反應式OH-+HCO3-+Ba2+=BaCO3↓+H2O,原溶液一定存在HCO3-,Fe3+和HCO3-發生雙水解反應,原溶液中一定不存在Fe3+,n(HCO3-)=n(BaCO3)=19.7g÷197g/mol=0.1mol,溶液B中通入氯氣,溶液顯淺黃綠色,說明原溶液中無Br-,
(1)根據上述分析,發生的反應是:HCO3-+Ba2++OH-=BaCO3↓+H2O;
(2)根據上述分析,一定沒有的陽離子是Fe3+、Ba2+;
(3)①如果氣體的單一氣體,則只能為CO2,說明原溶液中含有CO3-,n(CO32-)=n(CaCO3)=10.0g÷100g/mol=0.1mol,沉淀D為BaSO4,原溶液中一定含有SO42-,n(SO42-)=n(BaSO4)=11.65g÷233g/mol=0.05mol,溶液B中加入AgNO3和硝酸,有白色沉淀生成,此白色沉淀為AgCl,不能說明原溶液中一定含有Cl-,有BaCl2溶液引入,因此有(見答案);
②根據溶液顯電中性,NH4+含有電荷數為0.1mol·L-1,陰離子具有電荷數為(0.1×2+0.1+0.05×2)mol=0.4mol,顯然電荷不守恒,溶液中一定存在K+,且c(K+)最小濃度是(0.4-0.3)mol·L-1=0.1mol·L-1;
(4)D為混合氣體,沉淀A為BaCO3和BaSO3,可能含有BaSO4,因此原溶液中一定含有陰離子是:CO32-、HCO3-、SO32-;②根據以上分析可知沉淀A中能與稀硝酸反應的成分是BaCO3、BaSO3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】為增強鋁的耐腐蝕性,現以鉛蓄電池為外電源,以Al作陽極、Pb作陰極,電解稀硫酸,使鋁表面的氧化膜增厚。反應原理如下:
電池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O
電解池:2Al+3H2O![]() Al2O3+3H2↑ 電解過程中,以下判斷正確的是
Al2O3+3H2↑ 電解過程中,以下判斷正確的是
電池 | 電解池 | |
A. | H+移向Pb電極 | H+移向Pb電極 |
B. | 每消耗3 mol Pb | 生成2 mol Al2O3 |
C. | 正極:PbO2+4H++2e-===Pb2++2H2O | 陽極:2Al+3H2O-6e-===Al2O3+6H+ |
D. |
|
|
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將Y1L的H2和Y2L的N2在一定條件下發生反應,達到平衡后,混合氣體總體積為Y3L(氣體體積均在相同條件下測定),則生成NH3的體積是
A.(Y1+Y2-Y3)L B.(Y1+Y2+Y3)L C.(Y1+ Y2-2Y3)L D.[Y3-(Y1+Y2)]L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.反應AlCl3+4NaOH===NaAlO2+3NaCl+2H2O,可以設計成原電池
B.Zn和稀硫酸反應時,加入少量CuSO4溶液能加快產生H2的速率
C.把Fe片和Cu片放入稀硫酸中,并用導線把二者相連,觀察到Cu片上產生大量氣泡,說明Cu與H2SO4能發生反應而Fe被鈍化
D.Zn-Cu原電池工作過程中,溶液中H+向負極作定向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機物的系統名稱中,正確的是( )
A.2,4,4-三甲基戊烷 B.4-甲基-2-戊烯
C.3-甲基-5-異丙基庚烷 D、1,2,4-三甲基丁烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關活化分子和活化能的說法不正確的是
A.增加氣體反應物的濃度可以提高活化分子百分數
B.升高溫度可增加單位體積活化分子數
C.發生有效碰撞的分子一定是活化分子
D.使用催化劑可降低活化能,提高活化分子百分數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖裝置中,U型管內為紅墨水,a、b試管內分別盛有食鹽水和鹽酸,各加入生鐵塊,放置一段時間。下列有關描述錯誤的是
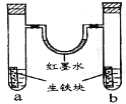
A.生鐵塊中的碳是原電池的正極
B.紅墨水柱兩邊的液面變為左低右高
C.兩試管中負極電極反應相同
D.a試管中發生了吸氧腐蝕,b試管中發生了析氫腐蝕
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com