
【題目】I.乳酸乙酯(2-羥基丙酸乙酯)常用于調制果香型、乳香型食用和酒用香精。為了在實驗室制取乳酸乙酯,某研究性學習小組同學首先查閱資料,獲得下列信息:
①部分物質的沸點:
物質 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
沸點/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃時,能按一定的比例以共沸物的形式一起蒸發。
該研究性學習小組同學擬采用如圖所示(未畫全)的主要裝置制取乳酸乙酯,其主要實驗步驟如下:
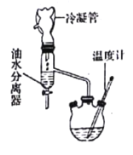
第一步:在反應容器中加入0.1 mol無水乳酸、45.0 mL(密度:0.789g/cm3)無水乙醇、一定量的苯和沸石……;裝上油水分離器和冷凝管,緩慢加熱回流2 h至反應完全。
第二步:將反應容器中液體倒入盛有適量5%Na2CO3溶液的燒杯中,攪拌并分出有機相后,再用水洗。
第三步:將無水CaCl2加入到水洗后的產品中充分靜置,過濾、蒸餾,得產品7.08 g。
(1)第一步操作中,還缺少的試劑是______________________;加入苯的目的是_________________;實驗過程中,若油水分離器中水層不再增厚,則表明___________________________________。
(2)第二步中證明“水洗”已經完成的實驗方案是_______________________________ 。
(3)本實驗制備乳酸乙酯的產率為_________________________。
Ⅱ.磷化鋁、磷化鋅、磷化鈣與水反應產生高毒的PH3氣體(熔點為-132℃,還原性強,易自燃),可用于糧食熏蒸殺蟲。衛生安全標準規定:當糧食中磷化物(以PH3計)的含量低于0.05m·kg-1時算合格。可用以下方法測定糧食中殘留的磷化物含量:
(操作流程)安裝吸收裝置![]() PH3的產生與吸收
PH3的產生與吸收![]() 轉移KMnO4吸收溶液
轉移KMnO4吸收溶液![]() 亞硫酸鈉標準溶液滴定。
亞硫酸鈉標準溶液滴定。
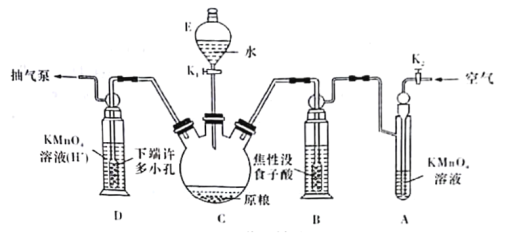
(實驗裝置)C中盛100 g原糧,D中盛有20.00mL 1.12×10-4 mol·L-1KMnO4溶液(H2SO4酸化)。請回答下列問題:
(4)儀器C的名稱是______________;檢查整套裝置氣密性的方法是___________________________________________________________________________。
(5)A中盛裝KMnO4,溶液的作用是除去空氣中的還原性氣體;B中盛裝焦性沒食子酸的堿性溶液.其作用是______________________________。D中PH3被氧化成磷酸,所發生反應的離子方程式為____________________________________________。
(6)把D中吸收液轉移至容量瓶中,加水稀釋至250mL,取25.00mL于錐形瓶中,用5.0×10-5 mol·L-1的Na2SO3標準溶液滴定剩余的KMnO4溶液,消耗標準Na2SO3溶液11.00 mL,則該原糧中磷化物(以PH3計)的含量為_________________________mg·kg-1。
【答案】濃硫酸 形成水、乙醇和苯的共沸物,分離反應生成的水,促進酯化反應正向進行 酯化反應達到平衡 測定水洗液的pH至7 60% 三頸燒瓶 關閉K1打開K2后,打開抽氣泵抽氣,觀察各裝置中是否有氣泡產生 吸收空氣中的O2,防止氧化裝置C中生成的PH3 5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O 0.0085
【解析】
I.(1)酯化反應過程中要用濃硫酸作催化劑和吸水劑;水、乙醇和苯形成共沸物,分離反應生成的水,能促進反應向正向進行;油水分離器中液體不再發生變化,說明反應已經達到了平衡狀態;
(2)水洗的目的主要是除去作催化劑的濃硫酸,洗滌液呈酸性;
(3)根據無水乙醇與無水乳酸的反應可知,參與反應的無水乙醇過量,利用乳酸的物質的量計算出生成的乳酸乙酯的物質的量,并進一步計算得到理論上生成乳酸乙酯的質量,最后就算出產率;
Ⅱ.C中盛有原糧100g,D中盛有20.00mL 1.12×10-4 mol·L-1KMnO4溶液(H2SO4酸化),吸收生成的PH3,B中盛裝的是沒食子酸的堿性溶液,其作用是吸收空氣中的O2,防止氧化裝置C中生成的PH3,A中盛裝的KMnO4溶液的作用是除去空氣中的還原性氣體;
(4)根據裝置圖確定儀器C的名稱;根據連續裝置中的壓強的變化分析檢查氣密性的方法;
(5) B中盛裝的是沒食子酸的堿性溶液,其作用是吸收空氣中的O2,防止氧化裝置C中生成的PH3;PH3被氧化成磷酸,高錳酸鉀被還原為Mn2+,結合電荷守恒和原子守恒書寫離子方程式;
(6)根據消耗的Na2SO3標準溶液的物質的量再結合定量關系計算出剩余的高錳酸鉀的量,進一步計算出吸收PH3需要的高錳酸鉀的物質的量,而后計算出PH3的物質的量,從而得到其含量。
I.(1)酯化反應過程中要用濃硫酸作催化劑和吸水劑,因此第一步操作中,缺少的試劑是濃硫酸;酯化反應是可逆的,混合物中添加苯可形成水、乙醇和苯的共沸物,分離反應生成的水,能促進反應向正向進行;油水分離器中液體不再發生變化,說明反應已經達到了平衡狀態;
(2)最后一次洗滌液不顯酸性,可說明洗滌完全,因此只需要測定最后一次的水洗液的pH至7;
(3)根據無水乙醇與無水乳酸的反應可知,參與反應的無水乙醇過量,利用乳酸的物質的量可計算出生成的乳酸乙酯的物質的量為0.1mol,其質量為0.1mol×118g/mol=11.8g,因此制備乳酸乙酯的產率為![]() ×100%=60%;
×100%=60%;
Ⅱ. (4)根據裝置圖可知儀器C為三頸燒瓶;根據連續裝置中的壓強變化,可以利用抽氣泵抽氣,觀察各裝置中氣體的產生,若有氣泡冒出,證明氣密性良好;
(5) 沒食子酸的堿性溶液,其作用是吸收空氣中的O2,防止氧化裝置C中生成的PH3;PH3被氧化成磷酸,高錳酸鉀被還原為Mn2+,離子方程式為:5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O;
(6) 滴定過程中發生的反應為2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O,根據反應方程式可知剩余的KMnO4的物質的量為5.0×10-5 mol·L-1×11.00×10-3L×![]() =2.2×10-7 mol;與PH3反應的KMnO4的物質的量為20.00×10-3L ×1.12×10-4 mol·L-1-2.2×10-7 mol×
=2.2×10-7 mol;與PH3反應的KMnO4的物質的量為20.00×10-3L ×1.12×10-4 mol·L-1-2.2×10-7 mol×![]() =4.0×10-8mol,因此吸收的PH3的物質的量為4.0×10-8mol×
=4.0×10-8mol,因此吸收的PH3的物質的量為4.0×10-8mol×![]() =2.5×10-8mol,因此原糧中磷化物(以PH3計)的含量為
=2.5×10-8mol,因此原糧中磷化物(以PH3計)的含量為![]() =0.0085mg/kg。
=0.0085mg/kg。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化學 來源: 題型:
【題目】SO2廣泛用于醫藥、硫酸工業等領域,回收廢氣中的SO2可用如下方法。
方法Ⅰ | 用堿式硫酸鋁Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空氣(O2)將SO2氧化為H2SO4 |
(1)方法Ⅰ的過程如下。
① 制備Al2(SO4)x(OH)y。向Al2(SO4)3溶液中加入CaO粉末,調pH至3.6。 CaO的作用是______
② 吸收:Al2(SO4)x(OH)y吸收SO2后的產物是______(寫化學式)。
③ 解吸:加熱②中產物,產生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化學方程式是______。
(3)方法Ⅱ中,Fe2+的催化過程可表示如下:
ⅰ:2Fe2++O2+SO2=2Fe3++SO42-
ⅱ:……
① 寫出ⅱ的離子方程式:______。
② 下列實驗方案可證實上述催化過程。將實驗方案補充完整。
a.向FeCl2溶液滴入KSCN,無變化
b.向FeCl2溶液通入少量SO2,滴入KSCN,顏色變紅。
c.取b中溶液,______。
(4)方法Ⅱ中,催化氧化后,采用滴定法測定廢氣中殘留SO2的含量。將V L(已換算為標準狀況)廢氣中的SO2用1%的H2O2完全吸收,吸收液用如圖所示裝置滴定,共消耗a mL c mol/L NaOH標準液。

①H2O2氧化SO2的化學方程式______。
② 廢氣中殘留SO2的體積分數為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某試液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干種離子,離子濃度均為0.1mol·L-1,某同學進行了如下實驗,下列說法正確的是

A. 無法確定原試液中是否含有Al3+、Cl-
B. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
C. 無法確定沉淀C的成分
D. 濾液X中大量存在的陽離子有NH4+、Fe2+和Ba2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂稀土合金廣泛應用于航空、航天、電子、通訊和汽車制造業等領域。熔鹽電解法是一種高效制備鎂稀土合金的方法,實驗室制取Mg-Gd合金(物質的量比為1:1)的電解槽示意圖如下(相對原子質量Mg—24,Gd—157),下列說法正確的是

A.添加LiF、BaF2的作用是催化劑
B.陽極的電極反應式為2F——2e—= F2 ↑
C.當電路中通過0.1mol電子時,生成Mg- Gd合金的質量為3.62 g
D.電解結束后,鋁、碳電極質量不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是 ( )

A.通電后中間隔室的SO42-向陽極遷移,陽極區溶液pH增大
B.該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
C.陰極反應為4OH--4e-=O2↑+2H2O,陰極區溶液pH降低
D.當電路中通過1mol電子的電量時,會有11.2L O2生成(標況)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一體積可變的密閉容器中,加入一定量的X、Y,發生反應:mX(g)![]() nY(g) ΔH=Q kJ/mol。反應達到平衡時,Y的物質的量濃度與溫度、氣體體積的關系如下表所示:
nY(g) ΔH=Q kJ/mol。反應達到平衡時,Y的物質的量濃度與溫度、氣體體積的關系如下表所示:
1L | 2L | 4L | |
100℃ | 1.00mol/L | 0.75mol/L | 0.53mol/L |
200℃ | 1.20mol/L | 0.90mol/L | 0.63mol/L |
300℃ | 1.30mol/L | 1.00mol/L | 0.70mol/L |
下列說法正確的是( )
A.溫度不變,壓強增大,Y的質量分數減少
B.體積不變,溫度升高,平衡向逆反應方向移動
C.m>n
D.Q<0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求填空:
(1)有機物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依據名稱寫出物質:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有機物降冰片二烯的分子結構可表示為: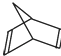
①降冰片二烯的分子式為 ______________;②降冰片二烯屬于 __________;
a.環烴 b.不飽和烴 c.烷烴 d.烯烴
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z在元素周期表中的位置如圖所示,下列說法正確的是( )
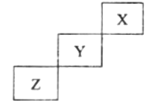
A.非金屬性強弱: Z> Y
B.氣態氫化物的穩定性: Y>Z
C.最高價氧化物的水化物酸性: Y>Z
D.常壓下X的單質化學性質非常活潑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表的形式多種多樣,下圖是扇形元素周期表的一部分(1~36號元素),對比中學常見元素周期表思考扇形元素周期表的填充規律,并回答下列問題:
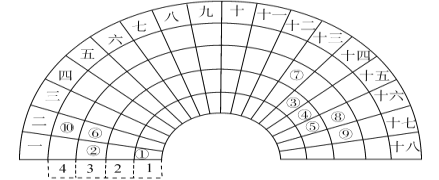
(1)若①~⑩分別代表十種元素,則⑩代表的元素處于常見周期表的位置是_______________________;
(2)⑥⑦為生活中兩種常見的金屬,其最高價氧化物對應水化物的堿性:⑥____⑦(填>、<或=);比較元素⑧⑨對應的常見單質氧化性的強弱,并用化學方程式證明:____________________________________;
(3)①③⑤三種元素形成的18電子結構化合物是近年來燃料電池研究領域的新寵,寫出用它作燃料,②最高價氧化物對應的水化物作為電解質的燃料電池的負極反應式:___________________________;
(4)用電子式表示④的一種10電子結構氫化物的形成過程:_________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com