
【題目】某工廠的工業廢水中含有大量的FeSO4,較多的CuSO4和少量Na2SO4。為了減少污染并變廢為寶,工廠計劃從該廢水中回收硫酸亞鐵和金屬銅。請根據下列流程圖,完成回收硫酸亞鐵和銅的實驗方案。(可供選擇的試劑為鐵粉、稀H2SO4、NaOH溶液等試劑)
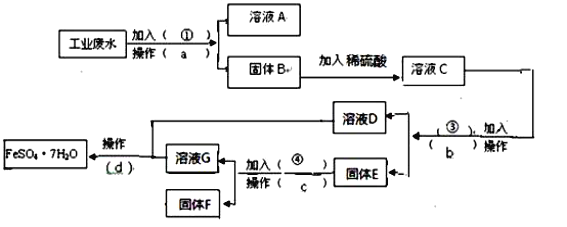
(1)操作a的名稱為 ,所需要的玻璃儀器除燒杯外還需要 。
(2)固體E的成分為 ,加入的試劑④為 ,發生的化學方程式為 。
(3)加入試劑①的目的是 。
(4)從溶液D和溶液G中得到FeSO4.7H2O晶體的操作為 、 、 、洗滌、干燥。
(5)若廢水中硫酸亞鐵、硫酸銅和硫酸鈉組成的混合溶液,其中c(Cu2+)=0.1 mol/L,c(Fe2+)=0.4 mol/L,
c(SO42-)= 0.6 mol/L,已知氫離子濃度忽略不計,則c(Na+)為________。
【答案】(1)過濾 漏斗、玻璃棒
(2)Fe和Cu 稀硫酸 Fe+H2SO4=FeSO4+H2↑
(3)將溶液中的Fe2+和Cu2+轉化為沉淀,便于與含有Na+的溶液分離
(4)蒸發濃縮、冷卻結晶、過濾
(5)0.2 mol/L
【解析】
試題分析:(1)加入試劑①后,過濾出Cu(OH)2,Fe(OH)2沉淀,濾液是Na2SO4、NaOH溶液;分離出液體和固體的操作是過濾;所需要的玻璃儀器為:漏斗、玻璃棒、燒杯;
(2)溶液C的成分為CuSO4,FeSO4、H2SO4,加過量鐵,過濾出Fe、Cu,溶液D中只有一種鹽是硫酸亞鐵,所以固體E就是Fe、Cu,所以固體F就是銅,過量的鐵是為了將CuSO4中的銅全部置換出來,加入過量試劑④稀硫酸的目的是除去銅中的鐵,實現了回收金屬銅,發生的化學方程式為:Fe+H2SO4=FeSO4+H2↑;
(3)試劑①為NaOH溶液,為了實現Na+的溶液分離,可將溶液中的Fe2+和Cu2+轉化為沉淀;
(4)蒸發是從溶液中獲得晶體常采用的方法,產生沉淀后通過過濾實現分離。
(5)根據電荷守恒,0.1 mol/L×2+0.4 mol/L×2+ c(Na+)= 0.6 mol/L×2,解得c(Na+)=0.2 mol/L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】(普通)化合物H是重要的有機物,可由E和F在一定條件下合成:(部分反應物或產物省略,另請注意箭頭的指向方向)
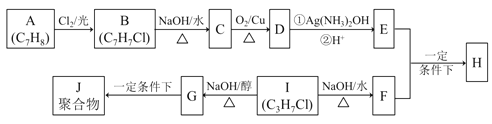
已知以下信息:
i.A屬于芳香烴,H屬于酯類化合物。
ii.I的核磁共振氫譜為二組峰,且峰的面積比為6:1。
回答下列問題:
(1)E的含氧官能團名稱 ,B的結構簡式 。
(2)B → C和G → J兩步的反應類型 , 。
(3)① E + F → H的化學方程式 。
② I → G 的化學方程式 。
(4)I的同系物K比I相對分子質量大28,K有多種同分異構體。
①K的同分異構體共 種。
②若K不能發生消去反應,則K的結構簡式為_________ _。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋼鐵生銹過程發生如下反應:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列說法正確的是
A. 反應①、②中電子轉移數目相等
B. 反應①中氧化劑是氧氣和水
C. 與銅質水龍頭連接處的鋼質水管不易發生腐蝕
D. 鋼鐵在潮濕的空氣中不能發生電化學腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國政府為了消除碘缺乏病,規定在食鹽中必須加入適量的碘酸鉀。檢驗食鹽中是否加碘,可利用如下反應:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)該反應的離子方程式為 。
(2)用“雙線橋”表示出反應中電子轉移的方向和數目:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(3)氧化產物與還原產物的質量之比為 。
(4)如果反應中轉移0.2mol電子,則生成I2的物質的量為_________mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學平衡原理在工農業生產中發揮著重要的指導作用。
(1) 反應C(s)+CO2(g)![]() 2CO(g)平衡常數K的表達式為 ;
2CO(g)平衡常數K的表達式為 ;
已知C(s) + H2O(g) ![]() CO(g)+H2(g)的平衡常數為K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常數為K1;H2(g)+CO2(g) ![]() CO(g)+H2O(g)的平衡常數為K2 ,則K與K1、K2二者的關系為 。
CO(g)+H2O(g)的平衡常數為K2 ,則K與K1、K2二者的關系為 。
(2)已知某溫度下,反應2SO2+O2![]() 2SO3,的平衡常數K=19 mol·L-1。在該溫度下的體積固定的密閉容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,當反應在該溫度下SO2轉化率為80%時,該反應是否達到化學平衡狀態?計算過程和結論如下 :
2SO3,的平衡常數K=19 mol·L-1。在該溫度下的體積固定的密閉容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,當反應在該溫度下SO2轉化率為80%時,該反應是否達到化學平衡狀態?計算過程和結論如下 :
(3)若未達到,反應向 (填“正反應”或“逆反應”) 方向進行。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaCN超標的電鍍廢水可用兩段氧化法處理:
(1)NaCN與NaClO反應,生成NaOCN和NaCl
(2)NaOCN與NaClO反應,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有劇毒;HCN、HOCN中N元素的化合價相同。
完成下列填空:
(1)第一次氧化時,溶液的pH應調節為____________(選填“酸性”、“堿性”或“中性”);原因是______________________。
(2)寫出第二次氧化時發生反應的離子方程式。
_______________________________________
(3)處理100 m3含NaCN 10.3 mg/L的廢水,實際至少需NaClO___g(實際用量應為理論值的4倍),才能使NaCN含量低于0.5 mg/L,達到排放標準。
(4)(CN)2與Cl2的化學性質相似。(CN)2與NaOH溶液反應生成_________、__________和H2O。
(5)上述反應涉及到的元素中,氯原子核外電子能量最高的電子亞層是___________;H、C、N、O、Na的原子半徑從小到大的順序為_______。
(6)HCN是直線型分子,HCN是___________分子(選填“極性”、“非極性”)。HClO的電子式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A. 糖類、油脂和蛋白質都是天然高分子化合物
B. 煤的干餾和石油的分餾都是化學變化
C. 苯的硝化反應屬于取代反應
D. 油脂都不能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【2016屆綿陽三診】NO能否與Na2O2反應?如果能反應,產物是什么?某興趣小組對此進行探究。
【查閱資料】①NO不與堿反應;②亞硝酸鹽除淺黃色的AgNO2難溶于水外,其余易溶于水;
③2NaNO3![]() 2NaNO2+O2↑,NaNO2熱穩定性很高。
2NaNO2+O2↑,NaNO2熱穩定性很高。
【實驗探究Ⅰ】興趣小組的同學經討論設計了如下圖所示實驗:
(1)儀器a的名稱是 ;干燥管D的作用是 。
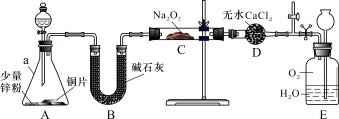
(2)從分液漏斗中加稀硝酸之前,先加入少量稀硫酸讓A中鋅粉完全溶解,其目的是 。
(3)若無B裝置,后果是 。
(4)實驗觀察到C中固體顏色變白,E中氣體先變紅棕色,最終又變無色。E中總反應的化學方程式是 。
【實驗探究Ⅱ】 該興趣小組進一步探究C中生成的白色固體的成分。
(5)提出假設:假設1. 白色固體只有NaNO2;假設2. 白色固體只有 ;
假設3. 白色固體是兩種物質的混合物。
(6)實驗驗證:①要證明假設2是否成立,實驗操作、現象和結論是____________________。
②為證明是假設1還是假設3成立,稱取C中生成的白色固體a g置于坩堝中(坩堝質量為c g),用酒精燈加熱至質量不再改變,冷卻后稱得坩堝和剩余固體總質量為b g,假設3成立時b-c的數字范圍是 。(用含a的不等式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗操作中正確的是
A. 洗滌沉淀的方法是直接向過濾器中加入適量蒸餾水,然后讓水自然流下
B. 用苯萃取溴水中的溴時,將溴的苯溶液從分液漏斗下口放出
C. 用100ml量筒量取9.5 mL的液體
D. 焰色反應中,觀察焰色后應趁熱將鉑絲插入到稀硫酸中,然后再次灼燒
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com