
【題目】下圖是以黃銅礦(主要成分為CuFeS2)為原料制取膽礬晶體的流程:
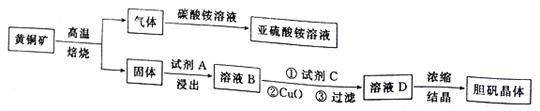
已知:
ⅰ.高溫焙燒時的主要反應有:2CuFeS2+O2![]() Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
2Cu2S+ 5O2![]() 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2![]() 2FeO+2SO2 ;
2FeO+2SO2 ;
ⅱ.常溫下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合價為______________________,寫出上述流程中生成亞硫酸銨的化學方程式:______________________________________________________________________。
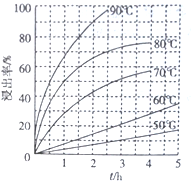
(2)最適合的試劑A是__________(寫化學式)溶液;當試劑A的濃度為6.0mol·L-1時 ,“浸出”實驗中,銅的浸出率結果如下圖所示。由圖可知,當銅的浸出率為90% 時,所采用的實驗條件(溫度、時間)為__________。
(3)最適合的試劑C是__________(填標號)。
a.Cl2b. H2O2 溶液 c.酸性高錳酸鉀溶液 d.濃硫酸
(4)加入適量CuO粉末的作用是調節溶液的pH,促進Fe3+水解,達到除雜的目的。寫出實現該目的的總反應的離子方程式:_________________________________________________________。
(5)有同學懷疑CuO不一定能達到上述目的,而小張同學卻認為可以通過計算來確定。設溶液中Cu2+的濃度為3.0 mol·L-1,則Cu2+開始沉淀時溶液的pH 為__________,Fe3+沉淀完全時溶液的pH 為__________。通過計算判斷加入CuO__________(填“能”或“不能”)達到目的(提示:1g 5=0.7;通常認為殘留在溶液中的某離子濃度小于1.0×10-5 mol·L-1 時,就認為該離子已沉淀完全)。
(6)假設流程圖中消耗的CuO為ag,最終制得bg膽礬晶體,消耗黃銅礦的質量為cg,不考慮生產過程中的損失,則黃銅礦中CuFeS2的質量分數為__________(寫出原始的計算結果即可,不必化簡)。
【答案】 -2 SO2+(NH4)2CO3=(NH4)2SO3+CO2 H2SO4 90℃、2 h b 2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+ 4.0 3.0 能  ×100%
×100%
【解析】(1)CuFeS2中銅的化合價為+2價,鐵的化合價為+2價,根據元素化合價代數和為零可知硫的化合價為-2價;上述流程中黃銅礦高溫焙燒產生的氣體是二氧化硫,二氧化硫與碳酸銨反應生成亞硫酸銨和二氧化碳,反應的化學方程式為:SO2+(NH4)2CO3=(NH4)2SO3+CO2;(2)以黃銅礦為原料制取膽礬晶體,焙燒后生成的氧化物必須先用硫酸溶解,故最適合的試劑A是H2SO4;由圖中信息可知,當銅的浸出率為90% 時,所采用的實驗條件(溫度、時間)為:90℃、2h;(3)試劑C是將溶液B中的亞鐵離子氧化為鐵離子,在加入氧化銅調節pH值后水解轉化為沉淀而除去鐵,最適合的試劑C是H2O2 溶液,將亞鐵離子氧化為鐵離子的同時產生水,沒有引入新的雜質,答案選b;(4)加入適量CuO粉末的作用是調節溶液的pH,促進Fe3+水解生成氫氧化鐵,同時氧化銅溶解生成Cu2+,達到除雜的目的。實現該目的的總反應的離子方程式為:2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+;(5)常溫下Ksp[Cu(OH)2]=c(Cu2+)c2(OH-)=3.0 mol·L-1×c2(OH-)=3.0×10-20,則c(OH-)=1.0×10-10,c(H+)=1.0×10-4,pH=4.0,即Cu2+開始沉淀時溶液的pH 為4.0;通常認為殘留在溶液中的某離子濃度小于1.0×10-5 mol·L-1 時,就認為該離子已沉淀完全,Ksp[Fe(OH)3] =c(Fe3+)c3(OH-)=1.0×10-5 mol·L-1×c3(OH-)=8.0×10-38,則c(OH-)=1.0×10-11,c(H+)=1.0×10-3,pH=3.0,由于Cu2+開始沉淀時溶液的pH 為4.0,Fe3+沉淀完全時溶液的pH 為3.0,加入CuO能達到目的;(6)根據銅的質量守恒黃銅礦和加入的氧化銅中的銅的總質量先于膽礬晶體中銅的總質量,黃銅礦中CuFeS2的質量分數為x,則有:cg×x×![]() +ag×
+ag×![]() =bg,解得x=
=bg,解得x=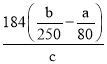 ×100%。
×100%。


 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJmol﹣1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJmol﹣1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJmol﹣1
則14g CO氣體與足量FeO充分反應得到Fe單質和CO2氣體時的釋放或吸收的熱量為( )
A.放出218 KJ
B.放出109kJ
C.吸收218 kJ
D.吸收109 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國北方大部分地區出現嚴重空氣污染,其主要原因是化石燃料的大量使用。提高利用率,減少化石燃料燃燒所造成的環境污染,已成為人類面臨的重大挑戰。
(1)氫氣是人類理想的能源。為了有效發展民用氫能源,首先必須制得廉價的氫氣。下列可供開發且比較經濟的制氫氣的方法是________(填序號)。
①電解水 ②鋅與稀硫酸反應 ③光解海水
制得氫氣后還需要解決的問題是____(寫出其中一個)。
(2)將CO2轉化成有機物可有效實現碳循環。CO2轉化成有機物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
葡萄糖
b.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2===CH2+4H2O
CH2===CH2+4H2O
以上反應中,最節能的是________,原子利用率最高的是________。
(3)煤液化后可得到甲醇,甲醇在一定條件下與CO、H2作用生成有機物A,A發生加聚反應可生成高分子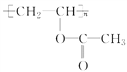 ,寫出A的結構簡式_________________。
,寫出A的結構簡式_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】蘊藏在海底的大量“可燃冰”,其開發利用是當前解決能源危機的重要課題。用甲烷制水煤氣(CO、H2),再合成甲醇可以代替日益供應緊張的燃油。下面是產生水煤氣的幾種方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ ![]() O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)與CO2 (g)反應生成CO(g)和H2(g)的熱化學方程式為。
(2)也可將CH4設計成燃料電池,來解決能源問題,如下圖裝置所示。持續通入甲烷,在標準狀況下,消耗甲烷VL。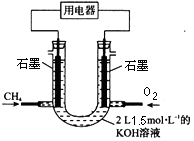
①0<V≤33.6L時,負極電極反應為。
②V=44.8L時,溶液中離子濃度大小關系為。
(3)工業合成氨時,合成塔中每產生1molNH3 , 放出46.1kJ的熱量。
某小組研究在上述溫度下該反應過程中的能量變化。他們分別在體積均為VL的兩個恒溫恒容密閉容器中加入一定量的反應物,使其在相同溫度下發生反應。相關數據如下:
容器 | 起始時各物質物質的量/mol | 達到平衡的時間 | 達平衡時體系 | ||
N2 | H2 | NH3 | |||
① | 1 | 4 | 0 | t1 min | 放出熱量:36.88kJ |
② | 2 | 8 | 0 | t2 min | 放出熱量:Q |
①容器①中,0-t1時間的平均反應速率為υ(H2)=。
②下列敘述正確的是 (填字母序號)。
a.平衡時,兩容器中H2的體積分數相等
b.容器②中反應達平衡狀態時,Q>73.76kJ
c.反應開始時,兩容器中反應的化學反應速率相等
d.平衡時,容器中N2的轉化率:①<②
e.兩容器達到平衡時所用時間t1>t2
(4)下圖是在反應器中將N2和H2按物質的量之比為1:3充入后,在200℃、400℃、600℃下,反應達到平衡時,混合物中NH3的體積分數隨壓強的變化曲線。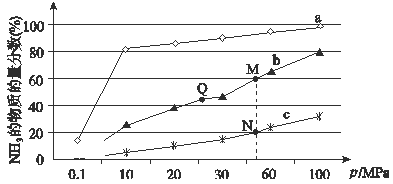
①曲線a對應的溫度是。
②上圖中M、N、Q點平衡常數K的大小關系是 。
③M點對應的H2轉化率是。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為測定某有機物A的結構,進行如下實驗. [分子式的確定]
(1)將有機物A置于氧氣流中充分燃燒,實驗測得:生成9.0g H2O和17.6g CO2 , 消耗氧氣13.44L(標準狀況下).則該物質的最簡式是 , 能否據此確定該有機物的分子式(若能則寫出其分子式,若不能請說明理由)
(2)根據價鍵理論,預測A可能的結構種(不考慮立體異構).
(3)[結構式的確定] 經測定,有機物A分子內有2種不同環境的氫原子,且A能與金屬鈉反應放出氣體,則A的結構簡式為 .
(4)[性質實驗] A在一定條件下脫水可生成B,B可發生加聚反應生成C,請寫出A轉化為B的化學反應方程式: .
(5)體育比賽中當運動員肌肉扭傷時,隊醫隨即用氯乙烷(沸點為12.27℃)對受傷部位進行局部冷凍麻醉.請選用B的某同系物和其他試劑及合適的方法制備氯乙烷,要求原子利用率為100%,寫出制備反應方程式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.將BaSO4放入水中不能導電,所以硫酸鋇不是電解質
B.NaCl溶液能導電,所以NaCl溶液是電解質
C.氯化氫溶于水能導電,所以鹽酸是電解質
D.固態的NaCl不導電,熔融態NaCl可以導電
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼氫化鈉(NaBH4)在化工等領域具有重要的應用價值,某研究小組采用偏硼酸鈉NaBO2為主要原料制備NaBH4 , 其流程如下: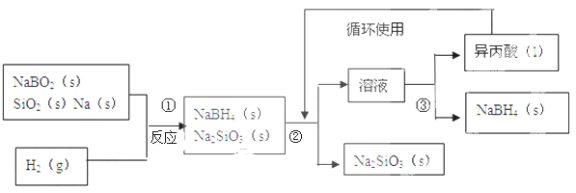
已知:NaBH4常溫下能與水反應,可溶于異丙酸(沸點:33℃)。
(1)在第①步反應加料之前,需要將反應器加熱至100℃以上并通入氬氣,該操作的目的是 ,原料中的金屬鈉通常保存在 中,實驗室取用少量金屬鈉需要用到的實驗用品有 , ,玻璃片和小刀等;
(2)請配平第①步反應的化學方程式: NaBO2+ SiO2+ Na+ H2=NaBH4+2Na2SiO3;
(3)第②步分離采用的方法是 ;第③步分離(NaBH4)并回收溶劑,采用的方法是 .
(4)NaBH4(s)與H2O(l)反應生成NaBO2(s)和H2(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放熱21.6KJ,該反應的熱化學方程式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國瀕臨海域的省份,能夠充分利用海水制得多種化工產品。如圖是以海水、貝殼(主要成分CaCO3)等為原料制取幾種化工產品的工藝流程圖,其中E是一種化肥,N是一種常見的金屬單質。
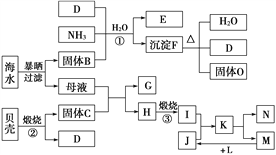
結合上述工藝流程圖回答下列問題:
(1)物質G和L的化學式分別為________和________________。
(2)上述工藝流程圖中可以循環使用的物質的化學式為______。
(3)反應①的化學方程式為______________________________;在反應①中必須先通入NH3,而后通入D,其原因是____________________。
(4)工業上利用F可制得另一種化工產品,該反應的化學方程式為________________。
(5)由K溶液經如何處理才能制得N?_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com