
【題目】黑火藥是我國古代的四大發明之一,距今已有1000多年的歷史。黑火藥爆炸的反應為2KNO3+3C+S=K2S+N2↑+3CO2↑,則該反應中的還原產物是( )
A.CO2B.N2和CO2C.K2S和N2D.S和KNO3
科目:高中化學 來源: 題型:
【題目】下列有關平衡常數的說法中,正確的是 ( )
A. 改變條件,反應物的轉化率增大,平衡常數也一定增大
B. 反應2NO2(g)![]() N2O4(g) △H <0,升高溫度該反應平衡常數增大
N2O4(g) △H <0,升高溫度該反應平衡常數增大
C. 對于給定可逆反應,溫度一定時,其正、逆反應的平衡常數相等
D. CO2+H2 ![]() CO+H2O的平衡常數表達式為K==
CO+H2O的平衡常數表達式為K==![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下的密閉容器中,可逆反應N2 + 3H2![]() 2NH3 達到平衡狀態的標志是
2NH3 達到平衡狀態的標志是
A. N2、H2、NH3在容器中共存
B. 混合氣體的總物質的量不再發生變化
C. 單位時間內生成n mol N2,同時生成3n mol H2
D. 單位時間內消耗n mol N2,同時消耗n mol NH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鑒別KCl溶液和K2CO3的試劑是____________,離子方程式為____________________。
(2)除去Na2CO3粉末中混入的NaHCO3雜質用______________________方法,化學方程式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實能用勒夏特列原理解釋的是
①由H2、I2蒸氣、HI組成的平衡體系加壓后顏色變深
②用排飽和食鹽水法收集Cl2
③高壓比常壓 有利于提高合成氨的產率
④高溫下合成氨速率較快
⑤工業制取金屬鉀Na(l)+ KCl(l) ![]() NaCl(l)+ K(g)選適宜的溫度,使K成蒸氣從反應混合物中分離出來
NaCl(l)+ K(g)選適宜的溫度,使K成蒸氣從反應混合物中分離出來
A. ②③⑤ B. ①②③⑤ C. ①②③④⑤ D. ②④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列依據熱化學方程式得出的結論正確的是
A. 等量固態硫燃燒比氣態硫燃燒放熱多
B. 已知2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1,則氫氣的燃燒熱為 241.8 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1,則氫氣的燃燒熱為 241.8 kJ·mol-1
C. 已知2C(s)+2O2(g)![]() 2CO2(g) ΔH=a 2C(s)+O2(g)
2CO2(g) ΔH=a 2C(s)+O2(g)![]() 2CO(g) ΔH=b,則a>b
2CO(g) ΔH=b,則a>b
D. 已知 NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,則含 40.0 g NaOH的稀溶液與稀醋酸完全中和,放出小于57.3 kJ 的熱量
NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,則含 40.0 g NaOH的稀溶液與稀醋酸完全中和,放出小于57.3 kJ 的熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,將足量固體A加入恒容真空容器中發生可逆反應:2A(s)![]() 2B(g)+C (g),下列能說明反應已達平衡狀態的是
2B(g)+C (g),下列能說明反應已達平衡狀態的是
A. 混合氣體的密度保持不變 B. 容器內B、C的濃度之比為2∶1
C. B的生成速率等于C的消耗速率 D. 氣體的體積分數保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸錳在電解錳、染料、造紙以及陶瓷等工業生產中有廣泛的應用。利用軟錳礦(主要成分為MnO2,含鐵的化合物等雜質)和閃鋅礦(主要成分ZnS)制得硫酸錳的流程如下:
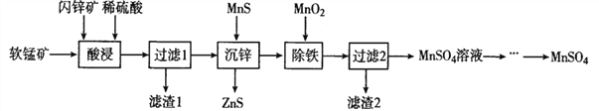
(1)“酸浸”時,為了縮短浸取時間,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反應轉變為兩種硫酸鹽的化學方程式為______________________。
(2)常溫下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉鋅”反應為:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),該反應的平衡常數K=__________________。
ZnS+Mn2+(aq),該反應的平衡常數K=__________________。
(3)在強酸性條件下加入MnO2氧化Fe2+的離子方程式為___________________。
(4)“除鐵”時需要調節pH約為3~4,過濾所得的濾渣2中除MnO2以外的另一種物質是________________。(寫化學式)
(5)該工藝流程中可以循環利用的物質是____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com