
| A、小于2% | B、大于5% | C、0.03%~2% | D、2%~4.3% |
科目:高中化學 來源: 題型:
 金屬腐蝕造成很大的經濟損失,甚至超過自然災害,其中鋼鐵銹蝕最為嚴重,尋求防止鋼鐵腐蝕的方法意義重大.
金屬腐蝕造成很大的經濟損失,甚至超過自然災害,其中鋼鐵銹蝕最為嚴重,尋求防止鋼鐵腐蝕的方法意義重大.| 1 |
| 5 |
| 2 |
| 9 |
| 1 |
| 4 |
| 1 |
| 3 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年福建省漳州市七校高三上學期第一次聯考化學試卷(解析版) 題型:實驗題
生鐵中除鐵外,還含有其他元素,如碳元素和硫元素。其中碳主要以碳化鐵的形態存在,它使生鐵性能堅硬而脆,所以生鐵的用途不大,一般用做煉鋼的原料。某興趣小組設計按下圖所示的實驗裝置,測定生鐵中的含碳量。

A??????????? B????????????????? C????????????????? D???????? E
請回答下列問題:
(1)硫在生鐵中是有害元素,它使生鐵產生熱脆性。硫元素在生鐵中最有可能存在的價態是???????????
A、-2?? ? B、0? ?? C、+4?? ?? D、+6
(2)寫出在燒杯E中發生反應的離子方程式:???????????????????????????? ;
(3)D中30% 雙氧水的作用是???????????????????????????????????????????????? ;若無此裝置,所測定的含碳量將??????? (填“偏高”、“偏低”或“不影響”)
(4)反應完成后,欲驗證生鐵含有硫元素,你所設計的實驗方案是(寫出實驗步驟、現象)???????????????????????????????????????????????????? ;
(5)待C管的樣品充分反應后,測得E中生成的沉淀為bg,請計算出生鐵中的含碳量為???????????? ;
(6)實驗過程中,該興趣小組應注意的安全問題是???????????????????? 。(任寫一種)
查看答案和解析>>
科目:高中化學 來源: 題型:
金屬腐蝕造成很大的經濟損失,甚至超過自然災害,其中鋼鐵銹蝕最為嚴重,尋求防止鋼鐵腐蝕的方法意義重大。
⑴鋼鐵的表面發藍、發黑處理是常用的防腐方法。下列反應是主要反應之一。
請配平化學方程式:
口Na2FeO2+ 口NaNO2+ 口 =口 NaFeO2+ 口NH3↑+ 口NaOH
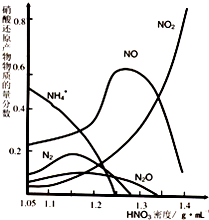
⑵鋼鐵的“鈍化”處理也能達到防腐目的,經冷、濃HNO3處理后,其表面有一層致密氧化物保護膜,但是加熱或在稀HNO3中就不能“鈍化”。不同濃度的HNO3與鐵反應的還原產物很復雜,其分布曲線如圖。

①圖示可知,密度大于1.35 g?mL-1的硝酸與鐵反應時,其還原產物主要是 ;密度為1.05g?mL-1 的硝酸與鐵反應時,其最多的還原產物是 ;分析HNO3與鐵反應的規律是 。
②工業上一般不用冷濃硝酸進行鐵表面處理,其可能的原因是: 。
⑶金屬 (M) 的腐蝕是因為發生反應: M-ne-→Mn+。鋼鐵除了上述表面處理的方法外,下列方法也能起到防腐作用的是 (填字母編號)。
A.在鐵中摻入鉻、鎳等金屬,改變其內部結構,制成不銹鋼
B.在鐵制品表面鍍鋅
C.提高鐵中含碳量,制成生鐵
D.將水庫鐵閘門與直流電源的負極相連
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com