
【題目】硫酸亞鐵銨(NH4)2Fe(SO4)26H2O又稱莫爾鹽,是淺綠色晶體。用硫鐵礦(主要含FeS2、SiO2等)制備莫爾鹽的流程如下:(已知:FeS2與H2SO4不反應)

(1)莫爾鹽屬于____________。
A、酸式鹽 B、堿式鹽 C、復鹽 D、硫酸鹽
(2)硫鐵礦焙燒的主反應是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫鐵礦焙燒速率的措施有__________,若150kg硫鐵礦(FeS2質量分數為80%)完全反應轉移電子數為________________________
2Fe2O3+8SO2,加快硫鐵礦焙燒速率的措施有__________,若150kg硫鐵礦(FeS2質量分數為80%)完全反應轉移電子數為________________________
(3)加H2SO4酸浸,發生反應的離子方程式為________________________________。
(4)“還原”時,Fe3+可通過反應Ⅰ、Ⅱ被FeS2還原。
反應Ⅰ的離子方程式為:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
反應Ⅱ的離子方程式為:_________________________________。
(5)為證明所得莫爾鹽晶體中含有Fe2+和NH4+,實驗方法是取其少量溶液于一支試管中,_______________證明含有Fe2+和NH4+。
【答案】C、D 將硫鐵礦粉碎、增大通入空氣的量或提高焙燒溫度 1.1×104NA Fe2O3+ 6H+ = 2Fe3++3H2O FeS2 +2Fe3+ = 3Fe2++2S 加入適量濃氫氧化鈉溶液,溶液中的白色沉淀迅速變灰綠,最終變為紅褐色;微熱,用濕潤的紅色石蕊試紙接近試管口,觀察到濕潤的紅色石蕊試紙變藍,證明含有Fe2+和NH4+
【解析】
硫鐵礦焙燒時,FeS2與氧氣高溫下反應生成氧化鐵和二氧化硫;加入稀硫酸,稀硫酸和氧化鐵反應生成硫酸鐵和水;硫酸鐵和FeS2反應生成硫酸亞鐵、硫(或硫酸);硫酸亞鐵溶液與硫酸銨溶液按一定比例混合,經蒸發濃縮、冷卻結晶、過濾、洗滌、干燥得硫酸亞鐵銨晶體。
(1)硫酸亞鐵銨(NH4)2Fe(SO4)26H2O是由兩種陽離子和一種酸根陰離子形成的鹽,屬于復鹽,也是硫酸鹽,故選CD;
故答案為:C、D;
(2)焙燒時,如果將硫鐵礦粉碎,增大固體表面積,可以加快硫鐵礦焙燒速率;如果鼓入過量空氣,增大氧氣濃度可以加快硫鐵礦焙燒速率;如果升高溫度,增大活化分子數,可以加快反應速率,
在4FeS2+11O2![]() 2Fe2O3+8SO2反應中,Fe和S的化合價都升高,氧元素化合價降低,1mol氧氣得4mol電子,若有4mol FeS2反應轉移電子44mol,則150kg硫鐵礦(FeS2質量分數為80%)完全反應轉移電子數為
2Fe2O3+8SO2反應中,Fe和S的化合價都升高,氧元素化合價降低,1mol氧氣得4mol電子,若有4mol FeS2反應轉移電子44mol,則150kg硫鐵礦(FeS2質量分數為80%)完全反應轉移電子數為![]() =1.1×104NA;
=1.1×104NA;
故答案為:將硫鐵礦粉碎、增大通入空氣的量或提高焙燒溫度;1.1×104NA;
(3)加H2SO4酸浸時,氧化鐵和硫酸反應生成硫酸鐵和水,反應的離子方程式為Fe2O3+ 6H+ = 2Fe3++3H2O,
故答案為:Fe2O3+ 6H+ = 2Fe3++3H2O;
(4)由流程圖可知,“還原”時,Fe3+和FeS2反應生成硫酸亞鐵、硫(或硫酸),則
反應Ⅱ的離子方程式為:FeS2 +2Fe3+ = 3Fe2++2S,
故答案為:FeS2 +2Fe3+ = 3Fe2++2S;
(5)Fe2+和NH4+均能與堿反應,Fe2+與氫氧化鈉溶液反應,溶液中立即生成白色沉淀,白色沉淀迅速變灰綠色,最終變為紅褐色;NH4+與氫氧化鈉溶液微熱反應,生成能使紅色石蕊試紙變藍的氣體,
故答案為:加入適量濃氫氧化鈉溶液,溶液中的白色沉淀迅速變灰綠,最終變為紅褐色;微熱,用濕潤的紅色石蕊試紙接近試管口,觀察到濕潤的紅色石蕊試紙變藍,證明含有Fe2+和NH4+。


科目:高中化學 來源: 題型:
【題目】將SO2氣體通入BaCl2溶液至飽和,未見有沉淀生成,繼續通入或加入另一種物質仍無沉淀產生,則通入或加入的物質不可能是( )
A. 氨水 B. CO2 C. 過氧化氫溶液 D. SO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請將符合題意的下列變化的序號填在對應的橫線上:①碘的升華;②氧氣溶于水;③氯化鈉溶于水;④燒堿熔化;⑤氯化氫溶于水;⑥氯化銨受熱分解。
(1)化學鍵沒有被破壞的是__________;僅發生離子鍵破壞的是__________;
(2)即發生離子鍵破壞、又發生共價鍵破壞的是____________________;
(3)N2的電子式為__________;Na2O2的電子式為___________;CO2的電子式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在有過氧化物存在的條件下,不對稱烯烴與HBr加成的反應規律是溴原子加在含氫較多的碳原子上,如: CH3—CH=CH2 + HBr![]() CH3CH2CH2Br。現有分子式為C8H13O2Cl的酯A,在一定條件下發生如下圖所示的一系列變化:
CH3CH2CH2Br。現有分子式為C8H13O2Cl的酯A,在一定條件下發生如下圖所示的一系列變化:
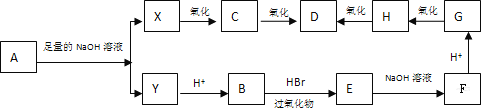
已知:A分子中不含甲基,試回答下列問題:
(1)寫出下列物質的結構簡式:Y____________、D___________。
(2)寫出下列反應的化學方程式:
①A和足量NaOH溶液共熱________________________________________;
②B→E ______________________________________________________________;
③X→C ______________________________________________________________;
④X與D發生縮聚反應:_______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,一種反應物過量,另一種反應物仍不能完全反應的是
A. 過量的銅與濃HNO3 B. 過量的濃鹽酸與二氧化錳
C. 過量的銅與濃硫酸 D. 過量的鋅與18 mol/L硫酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是一種重要的化工原料,其有關制備途徑及性質如圖所示下列說法正確的是
是一種重要的化工原料,其有關制備途徑及性質如圖所示下列說法正確的是
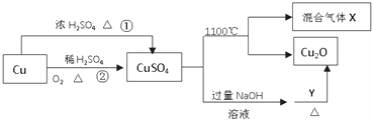
A. 相對于途徑①,途徑②更好地體現了綠色化學思想
B. 加Y加熱過程中,Y被還原
C. CuSO4在1100℃分解所得氣體X可能是SO2和SO3的混合氣體。
D. 將CuSO4溶液蒸干,可制得膽礬晶體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據題意完成下列問題:
(1)工業上利用CO和水蒸氣在一定條件下發生反應制取氫氣:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,寫出CO完全燃燒生成CO2的熱化學方程式:_______________________________________。
(2)隨著大氣污染的日趨嚴重,“節能減排”,減少全球溫室氣體排放,研究NO x、SO2、CO等大氣污染氣體的處理具有重要意義。用活性炭還原法處理氮氧化物,有關反應為:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小組向某密閉容器加入一定量的活性炭和NO,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
N2(g)+CO2(g)。某研究小組向某密閉容器加入一定量的活性炭和NO,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
濃度/mol·L-1 時間/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①則從反應開始到20mi時,以NO表示的平均反應速率= ________,該溫度下該反應的平衡常數K=____(保留兩位小數)
②30min后,改變某一條件,反應重新達到平衡,則改變的條件可能是_____(寫一條即可)。
③下列描述中能說明上述反應已達平衡的是__________;
A、容器內氣體的平均摩爾質量保持不變
B、2v(NO)正=v(N2)逆
C、容器中氣體的壓強保持不變
D、單位時間內生成nmolCO2的同時生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常溫下將SO2轉化為SO42-, 而實現SO2的處理(總反應為2SO2+O2+2H2O=2H2SO4)。已知,含SO2的廢氣通入含Fe2+、Fe3+的溶液時,其中一個反應的離子方程式為4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,則另一反應的離子方程式為_______________
(4)有學者想以如圖所示裝置用原電池原理將SO2轉化為重要的化工原料。

若A為SO2,B為O2,C為H2SO4,則負極反應式為_______________________________,電池總反應式為________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1989年世界衛生組織把鋁確定為食品污染源之一,加以控制使用。鋁在下列應用時應加以控制的是
①制鋁合金 ②制電線 ③制炊具 ④明礬凈水 ⑤明礬與蘇打制食品膨松劑
⑥用氫氧化鋁凝膠劑加工成胃舒平藥片 ⑦易拉罐 ⑧包裝糖果和小食品
A. ③⑤⑦⑧ B. ⑥⑦⑧ C. ③⑤⑧ D. ③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種瑞香素的衍生物的結構簡式如圖,下列有關該有機物性質的說法正確的是

A. 不能與FeCl3溶液發生顯色反應
B. 1 mol該有機物最多可與3 mol H2加成
C. 1 mol該有機物最多可與含5 mol NaOH溶液反應
D. 1 mol該有機物與足量NaHCO3溶液反應可放出3 mol CO2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com