
【題目】已知NA是阿伏加德羅常數的值,下列說法正確的是
A.72gCaO2中陰離子數目為2NA
B.將0.1molCl2通入1L水中,轉移的電子數為0.1NA
C.標準狀況下,11.2LO2和22.4LNO在密閉容器中充分混合后,氣體分子總數小于NA
D.室溫下1LpH=13的NaOH溶液中,水電離出的OH-的數目為0.1NA
【答案】C
【解析】
A.72gCaO2的物質的量為1mol,1mol過氧化鈣中含1molO22-,故1mol過氧化鈣中含NA個陰離子,A選項錯誤;
B.氯氣與水反應為可逆反應,不能進行到底,所以將0.1molCl2通入水中,轉移電子數小于0.1NA,B選項錯誤;
C.標準狀況下,11.2LO2和22.4LNO的物質的量分別為0.5mol和1mol,兩者混合后轉化為NO2,但容器內存在反應2NO2![]() N2O4,則氣體分子總數小于NA,C選項正確;
N2O4,則氣體分子總數小于NA,C選項正確;
D.在pH=13的氫氧化鈉溶液中,H+的物質的量濃度為10-13mol/L,全部來自于水的電離,而水電離出的氫氧根的濃度等于水電離出的氫離子的濃度,故pH=13的氫氧化鈉中,水電離出的OH-的個數為10-13NA,D選項錯誤;
答案選C。


 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:
【題目】芳香化合物F是有機化工的重要原料,也可制毒,受公安部管制。
已知:苯環上有烷烴基時,新引入的取代基連在烷烴基的鄰對位上;苯環上有羧基時,新引入的取代基連在羧基的間位上。
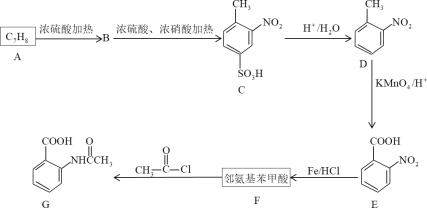
(1)D物質的名稱為___,G中官能團的名稱為___、___。
(2)A、F的結構簡式分別為___、___,E生成F的反應類型是___。
(3)寫出A→B產生較多的副產物的結構簡式___,該流程未采用甲苯直接硝化的方法制取D,而是經歷幾步反應才制得D的目的是___。
(4)F在一定條件下能發生聚合反應,請寫出其化學反應方程式___。
(5)F的同分異構體中,氨基直接連在苯環上、且能發生銀鏡反應的芳香族化合物共有___種(不含立體結構)。
(6)請以甲苯為原料,寫出合成間氨基苯甲酸的流程圖___(無機試劑任選)。合成流程圖表示方法示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,可逆反應X(g)+3Y(g)![]() 2Z(g)達到化學平衡狀態的標志是
2Z(g)達到化學平衡狀態的標志是
A.Z的生成速率和X的分解速率相等
B.單位時間內生成nmolX,同時生成了3nmolY
C.X、Y、Z的濃度不再變化
D.X、Y、Z的分子個數之比為1∶3∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗室產生的廢液中含有 Fe3+、Cu2+、Ag+三種金屬離子,甲同學設計了如下圖所示的方案對廢液進行處理,以回收金屬,保護環境。據此分析,下列說法正確的是( )
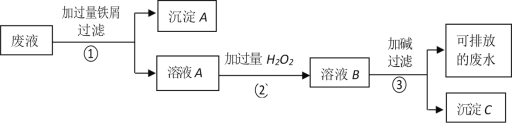
A. 沉淀 A 中含有 2 種金屬單質
B. 可用 KSCN 溶液來檢驗溶液 B 中所含的金屬離子
C. 溶液 A 若只經過操作③最終將無法得到沉淀 C
D. 操作①②③中都需要用到玻璃棒、漏斗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中進行如下反應: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始濃度分別為0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定條件下,當反應達到平衡時,各物質的濃度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始濃度分別為0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定條件下,當反應達到平衡時,各物質的濃度有可能是 ( )
A.Z 為 0.3mol/LB.Y2 為 0.4mol/LC.X2 為 0.2mol/LD.Z 為 0.4mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下向一定濃度的Na2X溶液中滴入鹽酸,粒子濃度與混合溶液的pH變化的關系如圖所示,已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=-lgY。下列敘述錯誤的是
,pY=-lgY。下列敘述錯誤的是
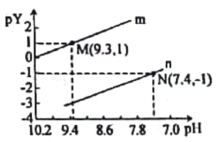
A.曲線n表示![]() 與pH的變化關系
與pH的變化關系
B.Ka1(H2X)=1.0×10-10.3
C.NaHX溶液中c(OH-)>c(H+)
D.當pH=7時,混合溶液中c(Na+)=c(HX-)+2c(X2-)+c(Cl-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應A2(g)+B2(g)===2AB(g)的能量變化如圖所示。下列有關敘述正確的是
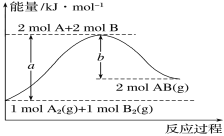
A.每生成2molAB(g)吸收bkJ熱量
B.斷裂1molA—A鍵和1molB—B鍵,放出akJ能量
C.該反應中反應物的總能量高于生成物的總能量
D.反應熱ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數,下列說法正確的是
A. 1 mol氦氣中有2NA個氦原子
B. 2 L 0.3 mol·L-1Na2SO4溶液中含0.6NA個Na+
C. 14 g氮氣中含NA個氮原子
D. 18 g水中所含的電子數為8NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,NaCN溶液中CN-、HCN濃度所占分數(δ)隨pH變化的關系如圖甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的鹽酸,其pH變化曲線如圖乙所示[其中a點的坐標為(9.5,0.5)]。下列溶液中的關系中正確的是( )

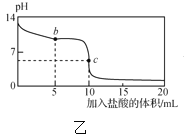
A.常溫下,HCN的電離平衡常數:Ka(HCN)=10-4.5
B.圖甲中pH=7的溶液:c(Cl-)=c(HCN)
C.圖乙中b點的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.圖乙中c點的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com