
【題目】某同學看到“利用零價鐵還原NO3-脫除地下水中硝酸鹽”的相關資料后,利用如下裝置探究鐵粉與KNO3溶液的反應。實驗步驟及現象如下:
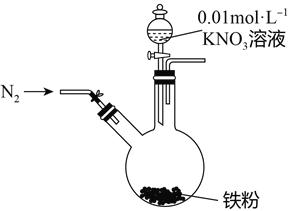
實驗步驟 | 實驗現象 |
1、打開彈簧夾,緩慢通入N2 | |
2、加入pH為2.5的0.01mol/L酸性KNO3溶液100mL | 鐵粉部分溶解,溶液呈淺綠色; 鐵粉不再溶解后,剩余鐵粉表面出現少量白色物質附著。 |
3、反應停止后,拔掉橡膠塞,將圓底燒瓶取下 | 燒瓶內氣體的顏色沒有發生變化。 |
4、將剩余固體過濾 | 表面的白色物質變為紅褐色。 |
(1)通入N2并保持后續反應均在N2氛圍中進行的實驗目的是______________________________。
(2)白色物質是__________,用化學方程式解釋其變為紅褐色的原因:____________________。
(3)為了探宄濾液的成分,該同學進一步設計了下述實驗:
實驗步驟 | 實驗現象 |
1、取部分濾液于試管中,向其中加入KSCN溶液 | 溶液液無變化 |
2、將上述溶液分為兩份,一份中滴入氯氣;另一份中滴加稀硫酸 | 兩份溶液均變為紅色 |
3、另取部分濾液于試管中,向其中加入濃NaOH溶液并加熱,在試管口放置濕潤的紅色石蕊試紙。 | 有氣體生成,該氣體使紅色石蕊試紙變藍。 |
(i)根據以上實驗現象,可以判斷濾液中存在____________________離子。
(ii)步驟2中滴加稀硫酸后溶液會由淺綠色變成紅色,請用離子方程式解釋其原因____________________。
【答案】 防止空氣中的O2對Fe和NO3-反應的干擾,避免影響反應產物的判斷 Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe2+、NH4+、NO3- 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
【解析】(1)空氣中的氧氣有強氧化性,為防止空氣中的O2對Fe和NO3-反應的干擾,避免影響反應產物的判斷,則整個反應需要在N2氛圍中進行;
(2)表面的白色物質變為紅褐色,可知該白色物質是Fe(OH)2,其遇空氣中的氧氣易氧化成顯紅褐色的Fe(OH)3,發生反應的化學方程式為4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)①取部分濾液于試管中,向其中加入KSCN溶液,溶液液無變化,可知不含有Fe3+;②上述溶液分為兩份,一份中滴入氯氣;另一份中滴加稀硫酸,兩份溶液均變為紅色,可知溶液里含有Fe2+和NO3-,因為在酸性條件下NO3-能氧化Fe2+;③另取部分濾液于試管中,向其中加入濃NaOH溶液并加熱,在試管口放置濕潤的紅色石蕊試紙,有氣體生成,該氣體使紅色石蕊試紙變藍,可知溶液里含有NH4+;
(i)根據以上實驗現象,可以判斷濾液中存在Fe2+、NH4+、NO3-;
(ii)步驟2中滴加稀硫酸后溶液會由淺綠色變成紅色,是溶液中NO3-在酸性條件下氧化Fe2+生成Fe3+,遇KSCN溶液顯紅色,發生反應的離子方程式為3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。


科目:高中化學 來源: 題型:
【題目】有些科學家提出硅是“21世紀的能源”,下列關于硅及其化合物的說法正確的是
A. SiO2是一種酸性氧化物,所以不和任何酸反應
B. 高溫下,可在試管內完成焦炭和石英砂(SiO2)制取硅的反應
C. 光導纖維的主要成分是SiO2
D. 自然界中硅元素的儲量豐富,主要以硅單質的形式存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人類歷史上,硅及其化合物的應用由來已久。請回答下列問題。
(1)高純硅是現代信息、半導體和光伏發電等產業都需要的基礎材料。工業上提純硅有多種路線,其中一種工藝流程示意圖及主要反應如下:

已知:反應②的反應為Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
上述反應①-④中,屬于置換反應的是______________________________;反應③中發生主要反應的化學方程式為_____________________________________;該工藝中可循環使用的物質為______________________________(填化學式)。
(2)用石英砂和焦炭在電弧爐中高溫加熱也可以得到無機材料碳化硅。請寫出制備碳化硅反應的化學方程式為________________________________________;碳化硅屬于晶體___________。(填晶體類型)
(3)氮化硅是一種耐高溫材料,粉末狀氮化硅可以由SiCl4的蒸氣和NH3反應制取。請問:
①氮化硅的化學式為______________________________。
②由SiCl4和NH3反應制取氮化硅的化學方程式為________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D、E、F原子序數依次增大.A的陽離子就是一個質子:B原子的最外層電子數是所在周期數的2倍;C、D在周期表中處于相鄰位置,它們的單質在通常狀況下均為無色氣體:E與A同一主族:F原子的K、L層電子數之和比K、M層電子數之和多l。A、D、E三種元素可形成化合物甲,B、D、E三種元素可形成化合物乙。請回答:
(1)C2的結構式為_______________。
(2)由上述元素組成的既含極性健又含非極性鍵的無機化合物分子的電子式為__________。
(3)A的單質與D的單質在強酸性條件下構成燃料電池,其正極反應式為__________。
(4)常溫下,甲與乙的水溶液pH均為9,這兩種溶液中由水電離出的OH-的物質的量濃度c(OH -)甲:c(OH-)乙= ________。
(5)將2.4gB的單質在足量D的單質中燃燒,所得氣體通入1L 0.3mol/L的甲溶液中,完全吸收后,溶液中的溶質為______。溶液中所含離子的物質的量 濃度由大到小的順序為______。
(6)由A、B、C、D四種元素組成的無機酸的酸式鹽,與足量的NaOH溶液在加熱條件下反應的離子方程式為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有六種短周期元素①H ②C ③N ④O ⑤Na ⑥Cl。
(1)①與③形成的化合物的電子式是__________,工業上利用該化合物制備NO的化學方程式___________。
(2)⑤的單質在④的單質中燃燒,生成淡黃色固體。該產物的電子式是______________________________,該產物中含有的化學鍵的類型是______________________________。
(3)②和⑥的氣態氫化物中熱穩定性較強的是__________(用化學式表示);能表示出②和⑥最高價氧化物水化物的酸性強弱的化學方程式是______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質用途的說法正確的是
A. 碳酸鈉用于治療胃酸過多 B. 稀硫酸用于除鐵銹
C. 晶體硅用于制造光導纖維 D. 硫酸鋇用于制作石膏繃帶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述不相符合的是
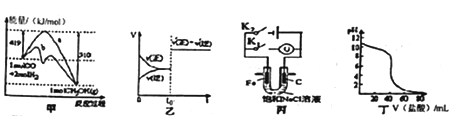
A. 圖甲表示工業上用CO生產甲醇的反應CO(g)+2H2(g) ![]() CH3OH(g)。該反應的 △H=-91 kJ·mol-1
CH3OH(g)。該反應的 △H=-91 kJ·mol-1
B. 圖乙表示己達平衡的某反應,在t0時改變某一條件后反應速率隨時間變化,則改 變的條件可能處加入催化劑
C. 圖丙中若K1閉合,石墨棒周圍液pH逐漸升高;若K2閉合,電路中通過0.002NA 個電子時,兩極理論上共產生0.002mol氣體
D. 圖丁表示鹽酸滴加0.1 mol·L-1NaOH溶液得到的滴定曲線,該實驗的指示劑最好選取酚酞
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,A處通入氯氣,打開B閥時,C處紅色布條不褪色;關閉B閥時,C處紅色布條褪色;由此作出的判斷正確的是( )
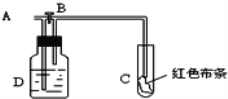
A. D中可能是濃硫酸
B. 通入的氯氣含有水蒸氣
C. D中可能是水
D. D中可能是NaOH溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com