
【題目】某學生用NaOH標準溶液滴定未知濃度的鹽酸,進項了如下實驗:
Ⅰ.實驗步驟:(請填空)
(1)滴定管在使用前應先檢驗是否漏液,然后用蒸餾水洗滌,最后用____潤洗。
(2)將氫氧化鈉溶液裝入滴定管排除氣泡并調節液面。如果液面初始位置如圖所示,則此時的讀數為____mL。
![]()
(3)取15.00mL待測鹽酸裝入錐形瓶中,滴加2滴酚酞作指示劑,滴定是邊滴邊搖動錐形瓶,眼睛應觀察____(選填編號).
a.滴定管內液面的變化 b.錐形瓶內溶液顏色的變化
Ⅱ.實驗記錄:
實驗次數 | 待測鹽酸體積(mL) | 標準氫氧化鈉溶液體積(mL) | ||
初讀數 | 末讀數 | 消耗體積 | ||
1 | 15.00 | 0.50 | 17.75 | ____ |
2 | 15.00 | 0.05 | 16.10 | 16.05 |
3 | 15.00 | 0.00 | 15.95 | 15.95 |
(4)請填寫1組反應消耗的氫氧化鈉溶液體積。
Ⅲ.數據處理與討論:
(5)處理數據時應舍去誤差明顯過大的異常數據,余下的數據中NaOH溶液的平均消耗值是___mL。若NaOH標準溶液的濃度為0.1020mol/L,該鹽酸的濃度為___mol/L。
(6)在本實驗過程中,下列操作不會造成實驗誤差的是___(選填編號)。
a.錐形瓶中加入待測溶液后,再加少量蒸餾水
b.錐形瓶在滴定時劇烈搖動,有少量液體濺出
c.見到指示劑的顏色有變化即停止滴定
【答案】氫氧化鈉溶液 0.70 b 17.25 16.00 0.1088mol/L a
【解析】
(1)滴定管使用前應用待裝液潤洗,以防止被稀釋,
故答案為:NaOH標準溶液;
(2)滴定管液面的讀數0.70mL,
故答案為:0.70;
(3)取15.00mL待測鹽酸裝入錐形瓶中,滴加2滴酚酞作指示劑,滴定是邊滴邊搖動錐形瓶,眼睛應觀察錐形瓶內溶液顏色的變化,根據溶液顏色的變化判斷終點;
答案選b;
(4)初讀數0.50mL,末讀數17.75mL,則消耗氫氧化鈉溶液體積為17.25mL;
故答案為:17.25;
(5)三次滴定消耗標準液體積分別為:17.251mL、16.05mL、15.95mL,第一組數據誤差較大,應該舍棄,另外兩組實驗中消耗標準液平均體積為:![]() =16.00mL,
=16.00mL,
NaOH~HCl
0.1020mol/L×16.00mL c(HCl)×15.00mL
解得:c(HCl)=0.1088mol/L
故答案為:16.00;0.1088;
(6)a.錐形瓶中加入待測溶液后,再加少量蒸餾水,導,待測液的物質的量不變,標準液的體積不變,結果不變,故a錯誤;
b.錐形瓶在滴定時劇烈搖動,有少量液體濺出,待測液的物質的量偏小,造成V(標準)偏小,根據c(待測)=![]() 分析,可知c(待測)偏小,故b錯誤;
分析,可知c(待測)偏小,故b錯誤;
c.見到指示劑的顏色有變化即停止滴定,造成V(標準)偏小,根據c(待測)=![]() 分析,可知c(待測)偏小,故c錯誤;
分析,可知c(待測)偏小,故c錯誤;
答案選a。


 王后雄學案教材完全解讀系列答案
王后雄學案教材完全解讀系列答案科目:高中化學 來源: 題型:
【題目】工業上研究高效處理煤燃燒釋放出來的SO2,有利于減小環境污染。在T℃時,利用CO處理SO2的反應為:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H=akJ/mol;
2CO2(g)+S(l) △H=akJ/mol;
(1)已知T℃時:C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol
S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol
C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
則T℃時,a=___。
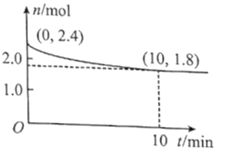
(2)在T℃下,將1.4molCO和1molSO2通入2L恒容容器中發生上述反應,反應體系氣體總物質的量隨時間變化如圖;在0~10min,反應的平均速率v(CO)=___,SO2的平衡轉化率![]() (SO2)=___%;在T℃時該反應的平衡常數Kc=___L/mol。
(SO2)=___%;在T℃時該反應的平衡常數Kc=___L/mol。
(3)實驗測得:v正=v(CO)消耗=k正c(CO)c(SO2),v逆=v(CO2)消耗=k逆![]() ,k正、k逆為只受溫度影響的速率常數。若將(2)中容器內的溫度升高(假設各物質的狀態不發生變化),
,k正、k逆為只受溫度影響的速率常數。若將(2)中容器內的溫度升高(假設各物質的狀態不發生變化),![]() 的值將___(填“增大”、“減小”或“不變”)。
的值將___(填“增大”、“減小”或“不變”)。
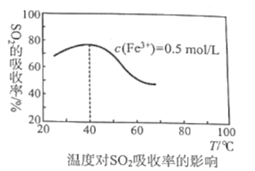
(4)某科研團隊研究用Fe2(SO4)3(aq)處理SO2:Fe3+溶液吸收SO2發生的離子反應方程式為___;其他外界條件不變下,在相同時間內溫度對SO2吸收率的影響結果如圖,在40℃前,SO2的吸收率隨溫度變化的可能原因是___;在40℃后,SO2的吸收率發生的變化是溫度升高該反應逆向移動的結果,導致反應逆向移動的原因:一是該反應為放熱反應,二是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
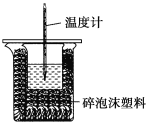
【題目】某實驗小組用100mL0.50mol/LNaOH溶液與60mL0.50mol/L硫酸進行中和熱的測定。裝置如圖所示,回答下列問題:
(1)若實驗共需要400mLNaOH溶液,實驗室在配制該溶液時,則需要稱量NaOH固體____g。
(2)圖中裝置缺少的儀器是____。
(3)硫酸稍過量的原因是____。
(4)請填寫下表中的平均溫度差:
實驗 次數 | 起始溫度T1/℃ | 終止溫度 T2/℃ | 平均溫度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似認為0.50 mol/L NaOH溶液與0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比熱容為c=4.18J/(g℃)則上述實驗中和熱ΔH=___(取小數點后一位)
(6)上述實驗結果與57.3kJ/mol有偏差產生偏差的原因可能是____
A.量取NaOH溶液時仰視讀數
B.為了使反應充分,可以向酸中分次加入堿
C.實驗裝置保溫隔熱效果差
D.用銅絲代替玻璃棒攪拌
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數,下列說法正確的是
A. 常溫常壓下,8gO2和O3的混合氣體含有4NA個電子
B. 1L0.1mol/L的FeCl3完全水解,形成0.1NA個Fe(OH)3膠體粒子
C. 標準狀況下,22.4LCl2通入水中發生反應,轉移的電子數為NA
D. 1molNa被完全氧化生成Na2O2,失去個2NA電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有甲、乙、丙、丁、戊五種烴,已知他們是C2H6、C3H6、C2H2、C6H6、C6H12(環己烷),實驗現象如下:
①甲、乙能使溴水因化學反應而褪色;②0.5mol甲能與1molH2生成丙,丙不能使溴水和酸性高錳酸鉀溶液褪色;③戊可由丁在一定條件下與氫氣反應得到。④比乙少一個碳原子的相鄰同系物可以在一定條件下和H2O反應得到W,W和醋酸反應會生成一種有香味的油狀液體。
(1)這五種烴分別是:甲是____(寫電子式);乙是____(寫結構簡式);丙是____(寫結構式);丁是____(寫名稱)。
(2)寫出下列化學方程式:
乙和溴水的反應:______。
實驗室制備甲的反應:______。
④中制得香味油狀液體的反應:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用如下裝置制取氯氣,并用氯氣進行實驗。回答下列問題:
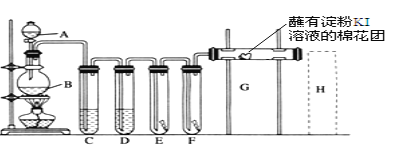
(1)A中盛有濃鹽酸,B中盛有MnO2,寫出反應的化學方程式___________。
(2)D中放入濃H2SO4,其目的是________。
(3)E中為紅色干布條,F中為紅色濕布條,可觀察到的現象是________,對比E和F中現象的差異可得出的結論及解釋____________________________。
(4)G是浸有淀粉KI溶液的棉花球,G處現象是棉花球表面變成______,反應的離子方程式是______________,H是浸有NaBr溶液的棉花球,H處現象是棉花球表面變成______。
(5)畫出H處尾氣吸收裝置圖并注明試劑________。
(6)現在有一種名為“凈水丸”的產品也能對飲用水進行快速的殺菌消毒,藥丸通常分內外兩層。外層的優氯浄Cl2Na(NCO)3先與水反應,生成次氯酸起殺菌消毒作用;幾分鐘后,內層的亞硫酸鈉(Na2SO3)溶出,可將水中的余氯(次氯酸等)除去。亞硫酸鈉將水中多余次氯酸除去的離子反應方程式為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下述轉化關系,回答問題:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物質苯環上一鹵代物只有兩種。
(1)寫出B物質的名稱__________;D物質的結構簡式________。
(2)寫出反應②的類型________;反應⑤的條件________。
(3)寫出反應⑥的化學方程式:________________________________。
(4)寫出D+E反應的化學方程式:_______________。
(5)反應②還有可能生成一種C16H18的有機物,其苯環上一鹵代物也只有兩種,寫出它的結構簡式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值.下列說法正確的是( )
A. 高溫下,0.2 mol Fe與足量水蒸氣反應,生成的H2分子數目為0.3NA
B. 室溫下,1 L pH=13的NaOH溶液中,由水電離的OH﹣離子數目為0.1NA
C. 氫氧燃料電池正極消耗22.4 L(標準狀況)氣體時,電路中通過的電子數目為2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反應中,生成28 g N2時,轉移的電子數目為3.75NA
2HNO3+4N2↑+9H2O反應中,生成28 g N2時,轉移的電子數目為3.75NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列有關說法正確的是( )
A.1L0.1molL-1NaNO2溶液中NO2-的數目為0.1NA
B.3.1g乙二醇中含有羥基的數目為NA
C.5.85gNa37Cl中所含質子總數為2.8NA
D.2.4g鎂條在足量的由N2和O2組成的混合氣體中完全燃燒時,轉移的電子總數一定為0.2NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com