
【題目】一定溫度下可逆反應:A(s)+2B(g)![]() C(g)+D(g);△H<0。現將1mol A和2mol B加入甲容器中,將2mol C和2mol D加入乙容器中,此時控制活塞P,使乙的容積為甲的2倍(如圖所示,隔板K不能移動),t1時兩容器內均達到平衡狀態。下列說法正確的是
C(g)+D(g);△H<0。現將1mol A和2mol B加入甲容器中,將2mol C和2mol D加入乙容器中,此時控制活塞P,使乙的容積為甲的2倍(如圖所示,隔板K不能移動),t1時兩容器內均達到平衡狀態。下列說法正確的是
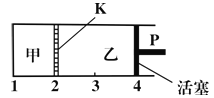
A.升高溫度,達到新平衡后,甲中B的體積分數增大,乙中B的體積分數減小
B.將活塞由“4”推進到“3”,達到新平衡后,甲、乙兩容器中C的百分含量相同
C.保持溫度不變,向甲中再加入1mol A和2mol B,達到新平衡后,c(B)甲>2c(B)乙
D.保持溫度和乙中壓強不變,向乙中再加入2mol D,達到新平衡后,c(B)乙≤2c(B)甲
 學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案
學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案 芒果教輔暑假天地重慶出版社系列答案
芒果教輔暑假天地重慶出版社系列答案科目:高中化學 來源: 題型:
【題目】下列“解釋或結論”與“實驗操作及現象”不相符的一組是
序號 | 實驗操作及現象 | 解釋或結論 |
A | 濃硫酸滴到紙張上,紙變黑 | 濃硫酸有脫水性 |
B | 向紫色石蕊溶液中加入氯水,溶液先變紅,隨后褪色 | 氯水中含有酸性物質和 漂白性物質 |
C | 向某溶液中加入稀鹽酸,產生能使澄清石灰水變渾濁的氣體 | 該溶液中一定有CO32- |
D | 向某溶液中加入濃NaOH溶液,加熱,產生能使濕潤的紅色石蕊試紙變藍的氣體 | 該溶液中一定含有NH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧元素為地殼中含量最高的元素,可形成多種重要的單質和化合物。
(1)氧元素位于元素周期表中___________區;第二周期元素中,第一電離能比氧大的有___________種。
(2)O3可用于消毒。O3的中心原子的雜化形式為___________;其分子的 VSEPR模型為___________,與其互為等電子體的離子為___________(寫出一種即可)。
(3)含氧有機物中,氧原子的成鍵方式不同會導致有機物性質不同。解釋C2H5OH的沸點高于CH3OCH3的原因為___________;C2H5OH不能用無水CaCl2千燥是因為Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,該離子的結構式可表示為______________________。
(4)氧元素可分別與Fe和Cu形成低價態氧化物FeO和Cu2O。

①FeO立方晶胞結構如圖1所示,則Fe2+的配位數為___________;與O2-緊鄰的所有Fe2+構成的幾何構型為___________。
②Cu2O立方晶胞結構如圖2所示,若O2-與Cu+之間最近距離為a pm,則該晶體的密度為___________g·cm-3。(用含a、NA的代數式表示,NA代表阿伏加德羅常數的值)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019 年 11 月《Science》雜志報道了王浩天教授團隊發明的制取H2O2 的綠色方法,原理如圖所示(已知:H2O2 ![]() H+ + H2O , Ka = 2. 4×10一12 )下列說法不正確的是
H+ + H2O , Ka = 2. 4×10一12 )下列說法不正確的是
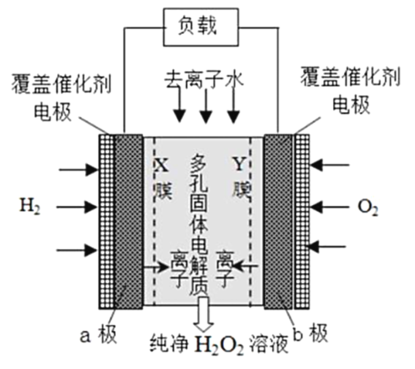
A.b 極上的電極反應為O2 +H2O +2e- =HO2 - +OH
B.X 膜為選擇性陽離子交換膜
C.催化劑可促進反應中電子的轉移,加快反應速率
D.每生成1 mol H2O2 電極上流過4 mole-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA 表示阿伏加德羅常數,下列敘述正確的是( )
A.常溫常壓下,4gH2含有的分子數為2NA
B.17g氨氣所含電子數目為8NA
C.將1體積c1mol/L的硫酸溶于4體積水中 ,稀溶液的濃度為0.2c1mol/L
D.將5.85gNaCl 晶體溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】食醋(主要成分CH3COOH )、純堿(Na2CO3 )和小蘇打(NaHCO3 )均為家庭廚房中常用的物質。已知:CH3COOH、H2CO3、HNO2的電離常數(25℃)分別為Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4請回答下列問題:
⑴一定溫度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶體時,下列說法正確的是____(填代號。)
a.溶液的pH增大 b.CH3COOH的電離程度增大
c.溶液的導電能力減弱 d.溶液中c(OH-)·c(H+)不變
⑵25℃時,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,則混合液中:
c(CH3COO-)/c(CH3COOH)=____
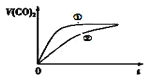
⑶常溫下,將20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分別與 20mL 0.1mol/LNaHCO3溶液混合,實驗測得產生的氣體體積(V)隨時間(t)的變化如圖所示,則表示CH3COOH溶液的曲線是_______(填寫序號);
⑷體積均為100mL pH=2的CH3COOH與一元酸HX,加水稀釋過程中pH與溶液體積的關系如圖所示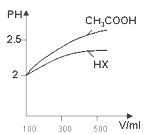 ,則HX的電離平衡常數______(填“大于”、“小于”或“等于”)CH3COOH的電離平衡常數。
,則HX的電離平衡常數______(填“大于”、“小于”或“等于”)CH3COOH的電離平衡常數。
⑸25℃時,將等體積、等物質的量濃度的醋酸與氨水混合后,溶液的pH=7,則NH3·H2O的電離常數Kb =___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】太和一中理化創新社的同學們為了探究在實驗室制備![]() 的過程中有水蒸氣和
的過程中有水蒸氣和![]() 揮發出來,同時證明氯氣的某些性質,甲同學設計了如圖所示的實驗裝置(支撐用的鐵架臺省略),按要求回答問題。
揮發出來,同時證明氯氣的某些性質,甲同學設計了如圖所示的實驗裝置(支撐用的鐵架臺省略),按要求回答問題。

(1)若用含有![]() 的濃鹽酸與足量的
的濃鹽酸與足量的![]() 反應制
反應制![]() ,制得的
,制得的![]() 體積(標準狀況下)總是小于
體積(標準狀況下)總是小于![]() 的原因是_____________________。
的原因是_____________________。
(2)①裝置B的作用是_______________________,現象是_____________________。
②裝置C和D出現的不同現象說明的問題是__________________________。
③裝置E的作用是_______________________________。
(3)乙同學認為甲同學的實驗有缺陷,不能確保最終通入![]() 溶液中的氣體只有一種。為了確保實驗結論的可靠性,證明最終通入
溶液中的氣體只有一種。為了確保實驗結論的可靠性,證明最終通入![]() 溶液的氣體只有一種,乙同學提出在某兩個裝置之間再加一個裝置。你認為該裝置應加在_________與_________之間(填裝置字母序號),裝置中應放入___________________________。
溶液的氣體只有一種,乙同學提出在某兩個裝置之間再加一個裝置。你認為該裝置應加在_________與_________之間(填裝置字母序號),裝置中應放入___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中進行反應:A(g)+3B(g)![]() 2C(g),有關下列圖像說法的不正確的是( )
2C(g),有關下列圖像說法的不正確的是( )
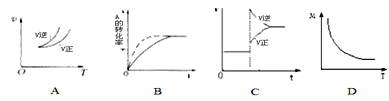
A. 依據圖A可判斷正反應為放熱反應
B. 在圖B中,虛線可表示使用了催化劑
C. 若正反應的△H<0,圖C可表示升高溫度使平衡向逆反應方向移動
D. 由圖D中混合氣體的平均相對分子質量隨溫度的變化情況,可推知正反應的△H>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎授予了對鋰離子電池方面的研究作出貢獻的約翰·B·古迪納夫(John B.Goodenough)等三位科學家。已知可充電鎳酸鋰離子電池的工作原理如圖所示,其總反應為:![]() 。下列說法不正確的是( )
。下列說法不正確的是( )
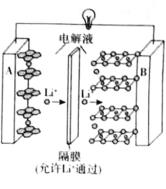
A.放電時,A電極為![]() 作原電池負極
作原電池負極
B.放電時,B電極反應式為![]()
C.充電時,A電極反應式為![]()
D.充電時,當電路中通過![]() 電子的電量時,A、B兩極質量變化差為
電子的電量時,A、B兩極質量變化差為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com