
【題目】下列圖示與對應的敘述相符的是
A.如圖表示反應2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0在有無催化劑時的能量變化
2SO3(g) ΔH<0在有無催化劑時的能量變化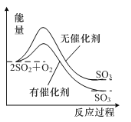
B.如圖表示電解精煉銅時純銅和粗銅的質量隨時間的變化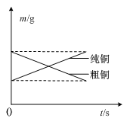
C.如圖表示鉛蓄電池放電時負極質量隨轉移電子物質的量的變化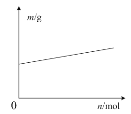
D.如圖表示反應2NO2(g)![]() N2O4(g)和2NO2(g)
N2O4(g)和2NO2(g)![]() N2O4(l)的能量變化
N2O4(l)的能量變化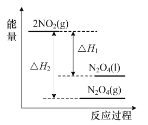
 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案 新黃岡兵法密卷系列答案
新黃岡兵法密卷系列答案科目:高中化學 來源: 題型:
【題目】如圖利用培養皿探究氨氣的性質,實驗時向NaOH固體上滴幾滴濃氨水,立即用另一培養皿扣在上面。下表中對實驗現象的描述及所做的解釋均正確的是
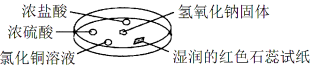
選項 | 實 驗 現 象 | 解 釋 |
A | 濃鹽酸附近產生白煙 | NH3與HCl反應生成了NH4Cl固體 |
B | 濃硫酸附近無明顯現象 | NH3與濃硫酸不發生反應 |
C | 氯化銅溶液變白色渾濁 | 白色渾濁的成分是Cu(OH)2 |
D | 濕潤的紅色石蕊試紙變藍 | NH3是一種可溶性堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的鎂鋁合金投入![]() 一定濃度的鹽酸中,合金完全溶解。向所得溶液中滴加濃度為
一定濃度的鹽酸中,合金完全溶解。向所得溶液中滴加濃度為![]() 的
的![]() 溶液,生成的沉淀跟加入的
溶液,生成的沉淀跟加入的![]() 溶液的體積關系如圖。(橫坐標體積單位是
溶液的體積關系如圖。(橫坐標體積單位是![]() ,縱坐標質量單位是g)求:
,縱坐標質量單位是g)求:
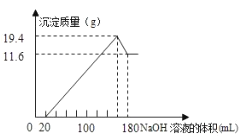
(1)合金中![]() ,
,![]() 的質量_____________
的質量_____________
(2)所用![]() 的物質的量濃度___________
的物質的量濃度___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨是一種重要的化工產品,也是重要的化工原料。某化學小組在實驗室制備氨并完成相關性質實驗。
(1)實驗一:用如圖所示裝置制備并收集 NH3。
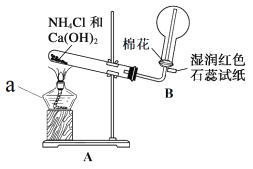
儀器 a 的名稱為____________,裝置 A 中產生 NH3 的化學方程式為____________, 裝置 B 中用圓底燒瓶收集 NH3 的方法為____________(填“向上排空氣法”或“向下 排空氣法”),當濕潤紅色石蕊試紙顏色變為____________色,表示已經收集滿 NH3。
(2)實驗二:用如圖所示裝置進行 NH3 的噴泉實驗。
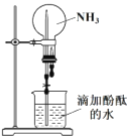
引發該噴泉實驗的操作是先____________,再打開止水夾,使燒杯內的水通過導管進入燒瓶形成噴泉,說明 NH3 具有的物理性質是____________,燒瓶內溶液呈紅色, 說明 NH3 的水溶液呈____________性。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A.向NaOH溶液中通入過量CO2:OH-+CO2=HCO![]()
B.向Na2SiO3溶液中滴加稀鹽酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C.電解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.SO2水溶液吸收Br2蒸汽:SO2+H2O+Br2=SO![]() +2H++2Br-
+2H++2Br-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】明礬石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化鐵,利用明礬石制備K2SO4的工藝流程如圖所示:
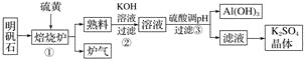
據此流程圖回答下列問題:
(1)①焙燒爐中Al2(SO4)3與S反應的產物是兩種氧化物,該反應的化學方程式為______;寫出爐氣的一種用途________。
(2)②中Al2O3參與反應的離子方程式為__________。
(3)③中調節pH不能用CO2的理由是____________________。
(4)工業冶煉金屬鋁需要定期更換補充陽極碳塊的原因是__________________。
(5)純凈氫氧化鋁經歷兩次__________________(填反應類型)可制得鋁。以Al和NiO(OH)為電極,NaOH溶液為電解液組成一種新型電池,放電時NiO(OH)轉化為Ni(OH)2,該電池負極的電極反應式是__________________。
(6)現有明礬石1 625 t,按上述流程制得780 t Al(OH)3,忽略鋁元素的損失,請計算明礬石中鉀元素的質量分數為____________%。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據提供的情境書寫指定反應的方程式。
(1)工業上以碳酸錳礦(主要成分為MnCO3,另含少量FeO、Fe2O3、CaO等雜質)為主要原料生產二氧化錳的工藝流程如下:
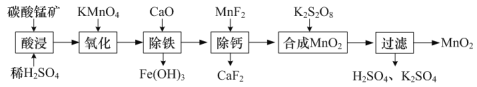
①“酸浸”時MnCO3發生反應的離子方程式為______。
②“氧化”時MnO![]() 轉化為Mn2+,該反應的離子方程式為_____。
轉化為Mn2+,該反應的離子方程式為_____。
③“合成MnO2”的化學方程式為______。
(2)氮氧化物是造成大氣污染的重要因素。
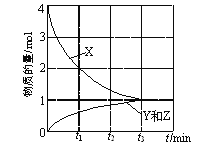
①在高壓下,NO在40 ℃下分解生成兩種化合物,體系中各組分的物質的量隨時間變化曲線如圖所示。NO分解的化學方程式為______。
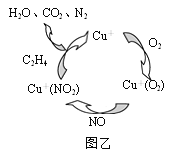
②一種以乙烯作為還原劑的脫硝(NO)機理示意圖如圖所示,該脫硝機理總反應的化學方程式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有CuO和Fe2O3組成的混合物ag,向其中加入2 molL﹣1的硫酸溶液50 mL,恰好完全反應。若將ag該混合物在足量H2中加熱,使其充分反應,計算冷卻后剩余固體質量_________。
(2)取一定量的CuO粉末與0.5 L稀硫酸充分反應后,將一根50 g鐵棒插入上述溶液中,至鐵棒質量不再變化時,鐵棒增重0.24 g。并收集到224 mL氣體(標準狀況)。求此CuO粉末的質量_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設 NA 表示阿伏加德羅常數的值,下列說法中正確的是
A.標準狀況下,22.4L CCl4 含有的原子數為 5NA
B.1.8g 的 NH4+中含有的電子數為 NA
C.常溫常壓下,32 g O2 和 O3 的混合氣體中所含原子數為 1.5 NA
D.7.1g Cl2 溶于水,轉移電子數目為 0.1NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com