
【題目】近年來,食品安全事故頻繁發生,人們對食品添加劑的認識逐漸加深。Butylated Hydroxy Toluene(簡稱BHT) 是一種常用的食品抗氧化劑,合成方法有如下兩種,下列說法正確的是( )
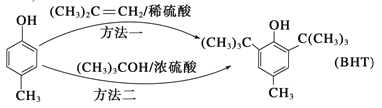
A. ![]() 不能與Na2CO3溶液反應
不能與Na2CO3溶液反應
B. ![]() 與BHT互為同系物
與BHT互為同系物
C. BHT久置于空氣中不會被氧化
D. 兩種方法的反應類型相同
科目:高中化學 來源: 題型:
【題目】芳香族化臺物肉桂酸甲酯常用于調制具有草莓、葡萄、櫻桃、香子蘭等香味的食用香精,其球棍模型如圖所示(圖中球與球之間的棍代表化學鍵,如單鍵、雙鍵等)。其制備過程涉及肉桂醇電解制備肉桂醛,肉桂醛氧化制備肉非酸,再與甲醇酯化制得。下列說法不正確的是

A. 肉桂酸甲酯的分子式為C10H10O2
B. 電解肉桂醇制得的肉桂醛在電解池的陰極生成
C. 1mol肉桂酸甲酯與H2加成最多消耗4mol
D. 肉桂酸甲酯中所有碳原子可能在同一平面內
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向X溶液中緩慢滴加Y溶液,生成沉淀的質量如圖所示,符合圖像的一組是

X | Y | |
A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
D | NaAlO2、氨水、NaOH | H2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在300 mL的密閉容器中,放入鎳粉并充入一定量的CO氣體,一定條件下發生反應:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知該反應平衡常數與溫度的關系如表所示:
Ni(CO)4(g),已知該反應平衡常數與溫度的關系如表所示:
溫度/℃ | 25 | 80 | 230 |
平衡常數 | 5×104 | 2 | 1.9×10-5 |
下列說法正確的是( )
A. 上述生成Ni(CO)4(g)的反應為吸熱反應
B. 25 ℃時反應Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常數為0.5
Ni(s)+4CO(g)的平衡常數為0.5
C. 在80 ℃時,測得某時刻,Ni(CO)4、CO濃度均0.5 mol/L,則此時v正>v逆
D. 80 ℃達到平衡時,測得n(CO)=0.3 mol,則Ni(CO)4的平衡濃度為2 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、硫及其化合物在工農業生產生活中有著重要作用。回答下列問題:
(1)有人設想利用CO還原SO2。已知S和CO的燃燒熱分別是296.0 kJ·mol1、283.0 kJ·mol1,請寫出CO還原SO2的生成CO2和S(s)熱化學方程式___________________________________。
(2)某科研小組研究臭氧氧化堿吸收法同時脫除SO2和NO工藝,氧化過程反應原理及反應熱、活化能數據如下:
反應Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反應Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知該體系中臭氧發生分解反應:2O3(g)![]() 3O2(g)。請回答:
3O2(g)。請回答:
其它條件不變,每次向容積為2 L的反應器中充入含2.0 mol NO、2.0 mol SO2的模擬煙氣和4.0 mol O3,改變溫度,反應相同時間t后體系中NO和SO2的轉化率如圖所示:

①由圖1可知相同溫度下NO的轉化率遠高于SO2,結合題中數據分析其可能原因_______。
②下列說法正確的是________。
A.Q點一定為平衡狀態點
B.溫度高于200℃后,NO和SO2的轉化率隨溫度升高顯著下降、最后幾乎為零
C.其它條件不變,若擴大反應器的容積可提高NO和SO2的轉化率
D.臭氧氧化過程不能有效地脫除SO2,但后續步驟堿吸收可以有效脫硫
③假設100℃時P、Q均為平衡點,此時反應時間為5min,發生分解反應的臭氧占充入臭氧總量的10%,則體系中剩余O3的物質的量是________mol;SO2的平均反應速率為________;反應Ⅰ在此時的平衡常數為_______________。
(3)以連二硫酸根(S2O42-)為媒介,使用間接電化學法也可處理燃煤煙氣中的NO,裝置如圖所示:

①ab是_______離子交換膜(填“陽”或“陰”)。陰極區的電極反應式為_____________。
②若NO吸收轉化后的產物為NH4+,通電過程中吸收4.48LNO(標況下),則陽極可以產生____mol氣體。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和鹽酸時沉淀的物質的量y mol與加入NaOH溶液和鹽酸的體積x mL的關系圖,根據圖示判斷,下列結論中不正確的是

A. N點時溶液中的溶質只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M點之前加入的是NaOH溶液,M點之后加入的是鹽酸
【答案】B
【解析】由圖象可知N→M發生Al(OH)3+OH-===AlO2-+2H2O,設氫氧化鈉溶液濃度為c,則消耗氫氧化鈉0.01cmol,n[Al(OH)3]=n(AlCl3)=0.01cmol;ON消耗氫氧化鈉0.05cmol,分別發生MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,可知n(MgCl2)=(0.05cmol-0.01c×3mol)/2=0.01cmol,則c(AlCl3):c(MgCl2)=1:1,M點時溶液成分為NaAlO2,之后繼續加入溶液后沉淀質量逐漸增大,此時應加入鹽酸,發生反應為:NaAlO2+HCl+H2O= Al(OH)3↓+NaCl,繼續加入鹽酸沉淀逐漸溶解,生成氯化鎂、氯化鋁和氯化鈉,則消耗的氫氧化鈉和HCl的物質的量相等,A.根據分析可知,N點時溶液中的溶質只有NaCl,A正確;B.原混合溶液中c(MgCl2):c(AlCl3)=1:1,B錯誤;C.由橫坐標可知消耗鹽酸和氫氧化鈉的體積相同,則二者物質的量濃度相同,C正確;D.根據分析可知,M點之前加入的是NaOH溶液,M點之后加入的是鹽酸,D正確;答案選B。
【題型】單選題
【結束】
16
【題目】證明某溶液中只含有Fe2+而不含有Fe3+的實驗方法是
①先滴加氯水,再滴加KSCN溶液后顯紅色
②先滴加KSCN溶液,不顯紅色,再滴加氯水后顯紅色
③滴加NaOH溶液,先產生白色沉淀,后變灰綠,最后呈紅褐色
④只需滴加KSCN溶液
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近浙江大學成功研制出具有較高能量密度的新型鋁一石墨烯(Cn)電池(如圖)。該電池分別以鋁、石墨烯為電極,放電時電池中導電離子的種類不變。已知能量密度=電池容量(J)÷負極質量(g)。下列分析正確的是
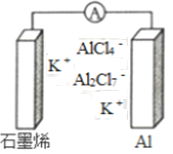
A. 放電時,Cn(石墨烯)為負極
B. 放電時,Al2Cl7-在負極轉化為AlCl4-
C. 充電時,陽極反應為4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以輕金屬為負極有利于提高電池的能量密度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com