
科目:高中化學 來源:2012屆江蘇省漣水中學高三12月階段性測試化學試卷(帶解析) 題型:填空題
鉻的化合物有毒,由于+6價Cr的強氧化性,其毒性是+3價Cr毒性的100倍。因此,必須對含鉻的廢水進行處理。目前研究和采用的處理方法主要有:
方法一、還原法:
(Ⅰ)在酸性介質中用FeSO4、NaHSO3等將+6價Cr還原成+3價Cr。具體流程如下: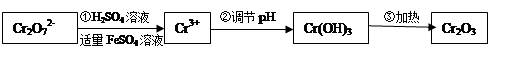
請回答下列問題:
(1)上述流程①發生反應的離子方程式是 。
(2)若在① 使FeSO4適當過量、空氣適量,可產生具有磁性、組成類似于鐵氧體(Fe3O4或FeO·Fe2O3)的復合氧化物( ·y
·y O)(注:X可以是分數),變廢為寶。則控制空氣適量的目的是 ,使鐵氧體分離出來較簡便的方法是 。假設處理含1 mol Cr2O72-的廢水至少需要加入10mol FeSO4·7H2O則復合氧化物(
O)(注:X可以是分數),變廢為寶。則控制空氣適量的目的是 ,使鐵氧體分離出來較簡便的方法是 。假設處理含1 mol Cr2O72-的廢水至少需要加入10mol FeSO4·7H2O則復合氧化物( ·y
·y O)化學式是 。
O)化學式是 。
(Ⅱ)研究發現,用鐵粉作還原劑不僅可以除去Cr6+,還能除去廢水中的少量Mn2+,現研究鐵屑用量和pH值對廢水中鉻、錳去除率的影響,
(3)取100mL廢水于250 mL三角瓶中,調節pH值到規定值,分別加入不同量的廢鐵屑.得到鐵屑用量對鉻和錳去除率的影響如下圖1所示。則在pH一定時,廢水中鐵屑用量為 時錳、鉻去除率最好
(4)取100mL廢水于250 mL三角瓶中,加入規定量的鐵粉,調成不同的pH值。得到pH值對鉻和錳去除率的影響如下圖2所示。則在鐵屑用量一定時,廢水pH= 時錳、鉻去除率最好

方法二、電解法:將含+6價Cr的廢水放入電解槽內,用鐵作陽極,加入適量的氯化鈉進行電解:陽極區生成的Fe2+和Cr2O72-發生反應,生成的Fe3+和Cr3十在陰極區與OH一結合生成Fe(OH)3和Cr(OH)3沉淀除去。
(5)寫出此陰極反應的電極方程式 。
(6)現用上法處理1×104 L含鉻(+6價)78 mg / L的廢水,電解時陽極物質消耗的質量至少為________kg。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三12月階段性測試化學試卷(解析版) 題型:填空題
鉻的化合物有毒,由于+6價Cr的強氧化性,其毒性是+3價Cr毒性的100倍。因此,必須對含鉻的廢水進行處理。目前研究和采用的處理方法主要有:
方法一、還原法:
(Ⅰ)在酸性介質中用FeSO4、NaHSO3等將+6價Cr還原成+3價Cr。具體流程如下:
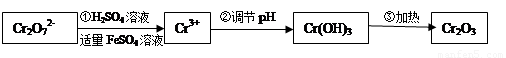
請回答下列問題:
(1)上述流程①發生反應的離子方程式是 。
(2)若在① 使FeSO4適當過量、空氣適量,可產生具有磁性、組成類似于鐵氧體(Fe3O4或FeO·Fe2O3)的復合氧化物( ·y
·y O)(注:X可以是分數),變廢為寶。則控制空氣適量的目的是 ,使鐵氧體分離出來較簡便的方法是 。假設處理含1 mol Cr2O72-的廢水至少需要加入10mol
FeSO4·7H2O則復合氧化物(
O)(注:X可以是分數),變廢為寶。則控制空氣適量的目的是 ,使鐵氧體分離出來較簡便的方法是 。假設處理含1 mol Cr2O72-的廢水至少需要加入10mol
FeSO4·7H2O則復合氧化物( ·y
·y O)化學式是 。
O)化學式是 。
(Ⅱ)研究發現,用鐵粉作還原劑不僅可以除去Cr6+,還能除去廢水中的少量Mn2+,現研究鐵屑用量和pH值對廢水中鉻、錳去除率的影響,
(3)取100mL廢水于250 mL三角瓶中,調節pH值到規定值,分別加入不同量的廢鐵屑.得到鐵屑用量對鉻和錳去除率的影響如下圖1所示。則在pH一定時,廢水中鐵屑用量為 時錳、鉻去除率最好
(4)取100mL廢水于250 mL三角瓶中,加入規定量的鐵粉,調成不同的pH值。得到pH值對鉻和錳去除率的影響如下圖2所示。則在鐵屑用量一定時,廢水pH= 時錳、鉻去除率最好


方法二、電解法:將含+6價Cr的廢水放入電解槽內,用鐵作陽極,加入適量的氯化鈉進行電解:陽極區生成的Fe2+和Cr2O72-發生反應,生成的Fe3+和Cr3十在陰極區與OH一結合生成Fe(OH)3和Cr(OH)3沉淀除去。
(5)寫出此陰極反應的電極方程式 。
(6)現用上法處理1×104 L含鉻(+6價)78 mg / L的廢水,電解時陽極物質消耗的質量至少為________kg。
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)混合動力汽車因具有能量利用率高(95%以上)、節省汽油、發動機噪音低和幾乎沒有尾氣污染等優良性能,受到越來越多的關注,某種混合動力汽車的動力系統由“1.3L汽油機+5速手動變速器+10kW電機+144V鎳氫電池”組成。
①汽油機的燃料之一是乙醇,1g乙醇完全燃燒放出29.7kJ熱量,寫出乙醇燃燒的熱化學方程式___________________________________。
②鎳氫電泄的使用可減少重金屬離子污染,它采用儲氫金屬作為負極,堿液(主要是KOH)作為電解液,鎳氫電池充電時發生反應:Ni(OH)2=== Ni(OH)+1/2H2。其放電時正極電極反應式為__________________________________。
③常溫下,濃度同為0.1mol·L-l的NaHCO3溶液和Na2CO3 溶液pH 值都大于7 ,兩者中_______ pH更大,其原因是:___________________________________。
(2)二氧化錳、鋅是制造干電池的重要原料,工業上用軟錳礦(含MnO2)和閃鋅礦(含ZnS)聯合生產二氧化錳、鋅的工藝如下:
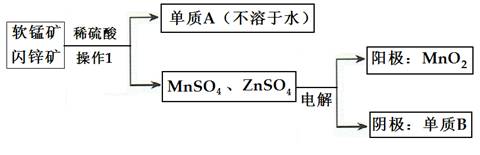
①操作1的名稱為___________,單質A為____________,單質B為______________。
②上述電解過程中,當陰極生成6.5gB時陽極生成MnO2質量為_________________。
③利用鋁熱反應原理,可從軟錳礦中提取單質錳,寫出其化學反應式:__________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)混合動力汽車因具有能量利用率高(95%以上)、節省汽油、發動機噪音低和幾乎沒有尾氣污染等優良性能,受到越來越多的關注,某種混合動力汽車的動力系統由“1.3L汽油機+5速手動變速器+10kW電機+144V鎳氫電池”組成。
①汽油機的燃料之一是乙醇,1g乙醇完全燃燒放出29.7kJ熱量,寫出乙醇燃燒的熱化學方程式___________________________________。
②鎳氫電泄的使用可減少重金屬離子污染,它采用儲氫金屬作為負極,堿液(主要是KOH)作為電解液,鎳氫電池充電時發生反應:Ni(OH)2=== Ni(OH)+1/2H2。其放電時正極電極反應式為__________________________________。
③常溫下,濃度同為0.1mol·L-l的NaHCO3溶液和Na2CO3 溶液pH 值都大于7 ,兩者中_______ pH更大,其原因是:___________________________________。
(2)二氧化錳、鋅是制造干電池的重要原料,工業上用軟錳礦(含MnO2)和閃鋅礦(含ZnS)聯合生產二氧化錳、鋅的工藝如下:
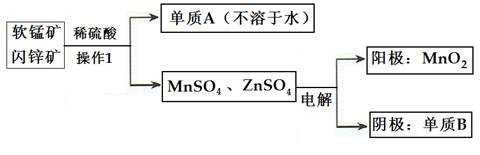
①操作1的名稱為___________,單質A為____________,單質B為______________。
②上述電解過程中,當陰極生成6.5gB時陽極生成MnO2質量為_________________。
③利用鋁熱反應原理,可從軟錳礦中提取單質錳,寫出其化學反應式:__________________________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com