
【題目】向某容積固定的密閉容器中加入0.3molA、0.1molC和一定量(未知)的B三種氣體,一定條件下發生反應,各物質濃度隨時間變化如圖所示。已知在反應過程中混合氣體的平均相對分子質量沒有變化。請回答下列問題。
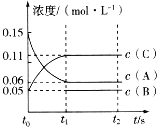
(1)密閉容器的容積是___L。
(2)若t1=15s,則t0~t1階段以C物質濃度變化表示的反應速率為v(C)=___。
(3)寫出反應的化學方程式:___。
(4)B的起始物質的量是___。
【答案】2 0.004mol·L-1·s-1 3A(g)![]() B(g)+2C(g) 0.04mol
B(g)+2C(g) 0.04mol
【解析】
由圖可知,A為反應物、C為生成物,由物質的量之比等于化學計量數之比可得A、C的化學計量數之比為(0.15—0.06):(0.11—0.05)=3:2,由反應過程中混合氣體的平均相對分子質量沒有變化可知,B為生成物,A、B、C的化學計量數之比為3:1:2,反應的化學方程式為3A(g)![]() B(g)+2C(g)。
B(g)+2C(g)。
(1)由題意可知,A的物質的量為0.3mol,由圖可知A的濃度為0.15mol/L,則容器的體積為![]() =2L,故答案為:2;
=2L,故答案為:2;
(2)由圖可知,t0~t1階段生成物C的濃度變化為0.11mol·L-1-0.05mol·L-1=0.06mol·L-1,則C的反應速率![]() ,故答案為:0.004mol·L-1·s-1;
,故答案為:0.004mol·L-1·s-1;
(3) 由圖可知,A為反應物、C為生成物,由物質的量之比等于化學計量數之比可得A、C的化學計量數之比為(0.15—0.06):(0.11—0.05)=3:2,由反應過程中混合氣體的平均相對分子質量沒有變化可知,B為生成物,A、B、C的化學計量數之比為3:1:2,反應的化學方程式為3A(g)![]() B(g)+2C(g),故答案為:3A(g)
B(g)+2C(g),故答案為:3A(g)![]() B(g)+2C(g);
B(g)+2C(g);
(4)根據化學方程式3A(g)![]() B(g)+2C(g)可知,B的物質的量的變化是C的一半,故B的物質的量的變化0.06mol,因此B的起始物質的量是0.05mol·L-1×2L-0.06mol=0.04mol,故答案為:0.04mol。
B(g)+2C(g)可知,B的物質的量的變化是C的一半,故B的物質的量的變化0.06mol,因此B的起始物質的量是0.05mol·L-1×2L-0.06mol=0.04mol,故答案為:0.04mol。


 優秀生快樂假期每一天全新寒假作業本系列答案
優秀生快樂假期每一天全新寒假作業本系列答案 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案科目:高中化學 來源: 題型:
【題目】右圖為直流電源電解稀Na2SO4水溶液的裝置。通電后在石墨電極a和b附近分別滴加幾滴石蕊溶液。下列實驗現象描述正確的是

A. 逸出氣體的體積,a電極的小于b電極的
B. 一電極逸出無味氣體,另一電極逸出刺激性氣體
C. a電極附近呈紅色,b電極附近呈藍色
D. a電極附近呈藍色,b電極附近呈紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在玻璃生產中,熔爐里原料發生的主要反應為:2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+3CO2↑。
2Na2SiO3+CaSiO3+3CO2↑。
(1)某反應物在熔融狀態下不導電,它屬于______晶體。
(2)上述反應里所涉及的短周期元素原子半徑由大到小的順序為________。
(3)碳和硅屬于同族元素,該族元素的原子最外層電子的價層電子表示式為________。
(4)寫一個能比較碳元素和氧元素非金屬性強弱的化學反應方程式:________。
(5)CO2的電子式為_______。
(6)反應物Na2CO3與CaCO3均能制備二氧化碳,但是往往不是都能使用稀硫酸,請說明理由。______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種新型的“鋰-呼吸CO2電池”,結構如圖所示,下列說法不正確的是
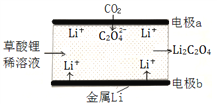
A. 該裝置是化學能轉變為電能
B. 利用該技術可減少溫室氣體CO2的排放
C. 正極的電極反應為:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+從正極遷移至負極
【答案】D
【解析】A、該裝置為原電池裝置,將化學能轉化為電能,故A正確;B、由圖可知,CO2轉化為C2O42-,可減少溫室氣體的排放,故B正確;C、CO2→C2O42-,碳元素化合價降低,得電子,則CO2在正極發生反應,電極反應為:2CO2 +2e-=C2O42-,故C正確;D、原電池中,陽離子向正極移動,故D錯誤。故選D。
【題型】單選題
【結束】
27
【題目】用惰性電極電解足量下列溶液一段時間后,再加入一定量括號內的純凈物,能使溶液恢復到原來的成分和濃度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】完成下列氧化還原反應相關問題:
I.配平下面的氧化還原方程式:_______
___ Na2SO3+____ KIO3+____ H2SO4 =____ Na2SO4+____ K2SO4+____ I2+____ H2O
II.KClO3和濃鹽酸在一定溫度下反應會生成黃綠色的易爆物二氧化氯。其變化可表述為
![]() (濃)
(濃)![]()
![]() 。
。
(1)請分析該反應中電子轉移的情況(用雙線橋表示)_______________。
(2)濃鹽酸在反應中顯示出來的性質是________(填序號)。
①只有還原性 ②還原性和酸性 ③只有氧化性 ④氧化性和酸性
若標準狀況下產生4.48L Cl2,則參加反應的KClO3的質量為_______g,被氧化的鹽酸的物質的量為________mol,轉移電子的物質的量為________mol。
(3)ClO2具有很強的氧化性,因此常被用作消毒劑,其消毒的效率(以單位質量得到的電子數表示)是Cl2的________倍。(提示:ClO2與Cl2消毒時氯元素都被還原為最低價)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中,進行如下反應:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol達到平衡后,為提高NO的轉化率,采取的正確措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol達到平衡后,為提高NO的轉化率,采取的正確措施是( )
A. 加催化劑B. 充入CO增大壓強C. 充入N2D. 升高溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.SO2是造成空氣污染的主要原因之一,可以Na2SO3溶液為吸收液除SO2。
(1)該反應的離子方程式是_____________________________________________________。
(2)已知NaHSO3溶液顯酸性,請結合離子方程式,用鹽的水解和電離理論進行解釋:_______________________________________________________________________。
(3)在Na2SO3稀溶液中各離子濃度從大到小排列順序是___________________________。
(4)往Na2SO3稀溶液加入少量KOH固體,完全溶解后(忽略溶解過程中溶液溫度變化)溶液中c(Na+) : c(SO32-) 的比值____________(填“變大”、“變小”或“保持不變”)。
II.工業上常用SO2除去原料氣中少量CO,生成物為固體S和CO2。
(5)寫出該反應的化學方程式為_______________________。
(6)上述反應中,每減少2.24L氣體(標準狀況下),轉移電子數為_____。
(7)上述反應所涉及的3種元素中,原子半徑從大到小的排列順序為_________;三種元素非金屬性由強到弱的順序為____________;反應所涉及的化合物中僅有一種是非極性分子,其電子式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將SO2通入BaCl2溶液至飽和的過程中,始終未觀察到溶液中出現渾濁,若再通入另一種氣體A,則產生白色沉淀。制備氣體A的試劑不能是
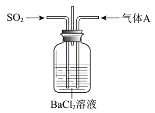
A.大理石和稀鹽酸B.Ca(OH)2和NH4Cl
C.Cu和濃硝酸D.MnO2和濃鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有三種物質AC2(氣體)、B2C2、AD4,元素A的最高正價和負價絕對值相等;元素B的單質能在C的氣態單質中劇烈燃燒,火焰呈黃色,并生成淡黃色固體B2C2;元素D的負一價陰離子電子層結構與氬原子相同,則:
(1)AC2、AD4的化學式分別為______、______。
(2)AD4分子其中含有的σ鍵類型為_______(填“s-s σ鍵”“s-p σ鍵”或“p-p σ鍵”)。
(3)D的負一價陰離子的電子排布式為_________,B2C2的電子式為__________,屬___________(填“離子化合物”或“共價化合物”)。
(4)寫出一種與AC互為等電子體的分子______________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com