
【題目】室溫下,向20mL濃度均為0.1mol/L的NaOH和MOH溶液中分別滴加0. 1mol/L鹽酸,溶液的pH隨鹽酸體積變化如圖所示。下列說法不正確的是( )

A.MOH的電離常數約為1×l0-5B.a點溶液中存在![]()
C.b點和c點溶液混合后顯堿性D.水的電離程度:d>b>a
【答案】D
【解析】
A.據圖知,0.1molL1MOH溶液中pH=11,則c(OH)=0.001molL1,MOH電離程度較小,則c(M+)≈c(OH)=0.001molL1,c(MOH)≈0.1molL1,常溫下,MOH的電離常數![]() ,A正確;
,A正確;
B.a點溶液呈堿性,則c(H+)<c(OH),根據電荷守恒得c(M+)+c(H+)=c(OH)+c(Cl),所以得c(M+)>c(Cl)≈![]() ,B正確;
,B正確;
C.當鹽酸的體積為10mL時,c點溶液為等物質的量濃度![]() 的NaCl和NaOH溶液,當鹽酸的體積為20mL時,b點為0.05molL1的MCl溶液,是強酸弱堿鹽,水解過程微弱,所以b點和c點溶液混合后顯堿性,C正確;
的NaCl和NaOH溶液,當鹽酸的體積為20mL時,b點為0.05molL1的MCl溶液,是強酸弱堿鹽,水解過程微弱,所以b點和c點溶液混合后顯堿性,C正確;
D. a點有堿溶液、d點酸過量,水的電離均受到抑制,b點溶質是強酸弱堿鹽,水解時促進水電離,從a到b點水的電離程度增大,從b到d點水的電離程度減小,故D錯誤;
答案選D。


科目:高中化學 來源: 題型:
【題目】某溫度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分別滴加0.1 mol·L-lAgNO3溶液。滴加過程中pM[-lgc(Cl-)或-lgc(CrO42-)]與所加AgNO3溶液體積之間的關系如下圖所示。已知Ag2CrO4為紅棕色沉淀。下列說法錯誤的是
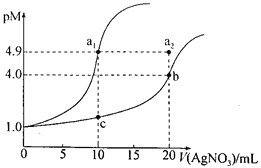
A. 該溫度下,Ksp(Ag2CrO4)=4×10-12
B. al、b、c三點所示溶液中c(Ag+):al>b>c
C. 若將上述NaCl溶液濃度改為0.2mol·L-1,則a1點會平移至a2點
D. 用AgNO3標準溶液滴定NaCl溶液時,可用K2CrO4溶液作指示劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】經研究發現白蟻信息素有:![]() (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),![]() (3,7-二甲基-1-辛烯),家蠶的性信息素為:CH3(CH2)3CH=CH—CH=CH(CH2)3CH3。下列說法正確的是( )
(3,7-二甲基-1-辛烯),家蠶的性信息素為:CH3(CH2)3CH=CH—CH=CH(CH2)3CH3。下列說法正確的是( )
A.以上三種信息素互為同分異構體
B.以上三種信息素均能使溴的四氯化碳溶液褪色
C.2,4-二甲基-1-庚烯與3,7-二甲基-1-辛烯互為同系物
D.家蠶的性信息素與1molBr2加成產物只有一種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某探究小組利用丙酮的溴代反應(CH3COCH3+Br2![]() CH3COCH2Br+HBr)來研究反應物濃度與反應速率的關系。反應速率 v(Br2) 通過測定溴的顏色消失所需的時間來確定。在一定溫度下,獲得如下實驗數據:
CH3COCH2Br+HBr)來研究反應物濃度與反應速率的關系。反應速率 v(Br2) 通過測定溴的顏色消失所需的時間來確定。在一定溫度下,獲得如下實驗數據:
實驗序號 | 初始濃度c/mol·L-1 | 溴顏色消失所需時間t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析實驗數據所得出的結論不正確的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.實驗②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是
A.乙酸與碳酸鈉溶液反應:2H++CO32﹣═CO2↑+H2O
B.醋酸溶液與新制氫氧化銅反應:CH3COOH+OH﹣═CH3COO﹣+H2O
C.苯酚鈉溶液中通入少量二氧化碳:C6H5O﹣+CO2+H2O→C6H5OH+CO32﹣
D.甲醛溶液與足量的銀氨溶液共熱HCHO+4[Ag(NH3)2]++4OH﹣![]() CO32﹣+2NH4++4Ag↓+6NH3+2H2O
CO32﹣+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰離子電池是現代高性能電池的代表,高性能的電極材料與物質結構密切相關。
(l) LiFePO4因具有良好的結構穩定性而成為新一代正極材料,這與PO43-的結構密切相關,PO43-的立體構型為____。P、O、S的電負性從大到小的順序為______________
(2)通常在電極材料表面進行“碳”包覆處理以增強其導電性。抗壞血酸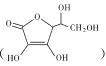 常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗壞血酸中碳原子的雜化方式為 ___,1mol抗壞血酸中手性碳原子的數目為______
常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗壞血酸中碳原子的雜化方式為 ___,1mol抗壞血酸中手性碳原子的數目為______
(3) Li+過度脫出易導致鋰電池結構坍塌產生O2而爆炸,實驗證實O2因具有單電子而成為順磁性分子,下列結構式(黑點代表電子)中最有可能代表O2分子結構的是____(填標號)。
A. ![]()
B. 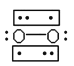
C. ![]()
D. 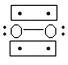
(4)目前最常用的電極材料有鋰鈷復合氧化物和石墨。
①鋰鈷復合氧化物中Li、Co、O分別形成了六邊層狀結構(圖a),按照Li-O-Co-O-Li–O-Co-O- Li--順序排列,則該化合物的化學式為____,Co3+的價層電子排布式為_____。
②石墨晶胞(圖b)層間距為d pm,C—C鍵長為a pm,石墨晶體的密度為p g/cm3,列式表示阿伏加德羅常數為____mol-l。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨反應為 N2(g)+3H2(g) ![]() 2NH3(g)△H=+92.4kJmol﹣1,下列說法正確的是( )
2NH3(g)△H=+92.4kJmol﹣1,下列說法正確的是( )
A.一定條件下,當N2的生成速率與N2的分解速率相等時,該反應處于平衡狀態
B.取1mol N2和3mol H2放在密閉容器內反應達平衡時,生成2 mol NH3
C.一定條件下反應達到平衡,再充入N2,則正反應速率增大,逆反應速率減小
D.一定條件下反應達到平衡,若升高溫度,反應速率增大,平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反應過程中能量變化的示意圖。一定條件下,在固定容積的密閉容器中該反應達到平衡狀態。當改變其中一個條件X,Y隨X的變化關系曲線如圖Ⅱ所示。
CO2(g)+NO(g)反應過程中能量變化的示意圖。一定條件下,在固定容積的密閉容器中該反應達到平衡狀態。當改變其中一個條件X,Y隨X的變化關系曲線如圖Ⅱ所示。

下列有關說法正確的是
A. 一定條件下,向密閉容器中加入1 mol NO2(g)與1 mol CO(g)反應放出234 kJ熱量
B. 若X表示CO的起始濃度,則Y表示的可能是NO2的轉化率
C. 若X表示溫度,則Y表示的可能是CO2的物質的量濃度
D. 若X表示反應時間,則Y表示的可能是混合氣體的密度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種以肼(N2H4)為燃料的新型環保電池的工作原理如圖所示。下列說法正確的是
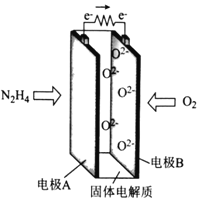
A. 電極A的電勢比電極B的低
B. 電極A的電極反應式為N2H4-4e-+4OH-===N2+4H2O
C. 電極B發生氧化反應
D. 每消耗11.2L的O2,轉移的電子數為2NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com