
【題目】已知A、B、C、D、E都是周期表中前四周期的元素,它們的核電荷數依次增大。其中A原子核外有三個未成對電子;A與B可形成離子化合物B3A2;C元素是地殼中含量最高的金屬元素;D原子核外的M層中有兩對成對電子;E原子核外最外層只有1個電子,其余各層電子均充滿。請根據以上信息,回答下列問題(答題時,A、B、C、D、E用所對應的元素符號表示):
(1)B的軌道排布式是_____________________________________,A、B、C、D的第一電離能由小到大的順序為___________________________________________。
(2)B的氯化物的熔點遠高于C的氯化物的熔點,理由是________________________;
(3)A的最高價含氧酸根離子中,其中心原子采取____________雜化,D的低價氧化物分子的空間構型是___________________________。
(4)A、E形成某種化合物的晶胞結構如圖所示,則其化學式為________________;(每個球均表示1個原子) 若相鄰A原子和E原子間的距離為a nm,阿伏伽德羅常數為NA,則該晶體的密度為_____________g/cm3(用含a、NA的符號表示)。

【答案】 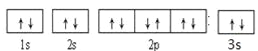 A1<Mg<S<N MgCl2為離子晶體而A1C13為分子晶體 sp2 V形 Cu3N
A1<Mg<S<N MgCl2為離子晶體而A1C13為分子晶體 sp2 V形 Cu3N ![]()
【解析】C元素是地殼中含量最高的金屬元素,所以C是Al元素,D原予核外的M層中有兩對成對電子,且D的原子序數大于C,所以D是S元素,E原子核外最外層只有1個電子,其余各層電子均充滿,且E是前四周期的元素,E的原子序數大于16,所以E是Cu元素,A原子核外有三個未成對電子,且原子序數小于13,所以A是N元素,A與B可形成離子化合物B3A2,且B的原子序數大于A小于C,所以B是Mg元素.
(1)B是Mg元素,核電荷數為12,根據核外電子排布規律B的軌道排布式是![]() ,Mg、Al、S元素是同一周期元素,同一周期元素的第一電離能逐漸增大,但鎂的第一電離能大于鋁的第一電離能,同一主族的第一電離能隨著原子序數的增大而減小,所以N元素的第一電離能大于P元素,P元素第一電離能大于S元素,所以Mg、Al、S、N元素的第一電離能由小到大的順序為Al<Mg<S<N。故答案為:
,Mg、Al、S元素是同一周期元素,同一周期元素的第一電離能逐漸增大,但鎂的第一電離能大于鋁的第一電離能,同一主族的第一電離能隨著原子序數的增大而減小,所以N元素的第一電離能大于P元素,P元素第一電離能大于S元素,所以Mg、Al、S、N元素的第一電離能由小到大的順序為Al<Mg<S<N。故答案為:  、 A1<Mg<S<N
、 A1<Mg<S<N
(2)氯化鎂是離子晶體,氯化鋁是分子晶體,所以離子晶體的熔點遠大于分子晶體的熔點,故答案為:MgCl2為離子晶體而A1C13為分子晶體
(3)A的最高價含氧酸根離子是NO3-,NO3-中,中心N原子價層電子對=3+![]() =3,所以N原子采取sp2雜化,D的低價氧化物是SO2,SO2的價層電子對=2+
=3,所以N原子采取sp2雜化,D的低價氧化物是SO2,SO2的價層電子對=2+![]() =3,含有一個孤電子對,所以分子空間構型是V形,故答案為:sp2、V形
=3,含有一個孤電子對,所以分子空間構型是V形,故答案為:sp2、V形
(4)該晶胞中白色球個數=![]() =1,黑色小球個數=12×
=1,黑色小球個數=12×![]() =3,N元素形成的負價是-3價,所以該晶胞中含有3個亞銅離子1個N離子,所以其化學式為Cu3N;
=3,N元素形成的負價是-3價,所以該晶胞中含有3個亞銅離子1個N離子,所以其化學式為Cu3N;![]() =
=![]() =
=![]() 故答案為:Cu3N、
故答案為:Cu3N、![]()


 導學全程練創優訓練系列答案
導學全程練創優訓練系列答案科目:高中化學 來源: 題型:
【題目】海水是一個巨大的化學資源寶庫,利用海水可以獲得很多化工產品。
(1)海水中制得的氯化鈉可用于生產燒堿及氯氣。反應的離子方程式是 。
(2)利用制鹽后的鹽鹵提取溴的工藝流程如下(部分操作和條件已略去):
![]()
將Br2與Na2CO3反應的化學方程式補充完整:
![]()
(3)鹽鹵蒸發冷卻后析出鹵塊的主要成分是MgCl2,此外還含Fe2+、Fe3+、Mn2+等離子。以鹵塊為原料制得鎂的工藝流程如下(部分操作和條件已略去):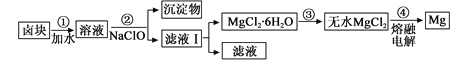
生成氫氧化物沉淀的pH
物質 | 開始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步驟②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的離子反應方程式是 。
③步驟③需在HCl保護氣中加熱進行,請用化學平衡移動原理解釋原因________。
④NaClO還能除去鹽鹵中的CO(NH2)2,生成鹽和能參與大氣循環的物質。除去0.1mol CO(NH2)2時消耗
NaClO g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列過程屬非自發的是
A. NaOH溶于水形成溶液 B. 水電解生成H2和O2
C. 氣體從高密度處向低密度處擴散 D. 一瓶N2和一瓶H2混合后,形成均勻的混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A常用于食品行業。已知4.5 g A在足量O2中充分燃燒,混合氣體依次通過足量的濃硫酸和堿石灰,分別增重2.7 g和6.6 g,經檢驗剩余氣體為O2。
(1)A分子的質譜圖如下圖所示,從圖中可知其相對分子質量為___,則A的分子式是____。

(2)A能與NaHCO3溶液發生反應,A一定含有的官能團名稱是________。
(3) A分子的核磁共振氫譜有4個峰,峰面積之比是1:1:1:3,則A的結構簡式是______。
(4)0.05 mol A與足量Na反應,在標準狀況下產生H2的體積是________L。
(5)A在一定條件下可聚合得到一種聚酯,用于制造手術縫合線,其反應的化學方程式是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列離子或物質的氧化性強弱順序為:ClO3->BrO3->Cl2>IO3-,試回答下列問題:
(1)反應:Cl2+I2+H2O→HCl+HIO3能否發生?_____(填“能”或“不能”)。若能,請配平_______________。若不能,請說明理由____。
(2)已知反應:PbO2+4HCl(濃)= PbCl2+Cl2↑+2H2O,濃HCl的作用是__,二者個數之比為__,若生成標況下氯氣28L,轉移電子個數為____,請將其改寫為離子方程式____。
(3)用雙線橋表示下面的反應:(得失電子數、化合價變化情況、被氧化/被還原)___________
3MnO2+KClO2+6KOH=3K2MnO4+KCl+3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.含有共價鍵的化合物一定是共價化合物
B.非金屬元素之間不可能形成離子化合物
C.氣體分子間一定存在分子間作用力,但分子內不一定含共價鍵
D.兩種不同的非金屬元素形成的化合物只存在極性共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2是一種消毒殺菌效率高、二次污染小的水處理劑.實驗室可通過以下反應制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.下列說法中正確的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列說法中正確的是( )
A. KClO3在反應中是還原劑
B. 1 mol KClO3參加反應,在標準狀況下能得到22.4 L氣體
C. 在反應中H2C2O4既不是氧化劑也不是還原劑
D. 1 mol KClO3參加反應有1 mol電子轉移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸鈉的溶液,恰好使鋇離子完全沉淀;另取一份加入含
硫酸鈉的溶液,恰好使鋇離子完全沉淀;另取一份加入含![]()
![]() 硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子濃度為
硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子濃度為
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下列實驗裝置進行相應的實驗(部分夾持裝置略去),不能達到實驗目的的是
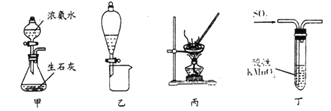
A. 利用圖甲裝置可快速制取少量氨氣
B. 利用圖乙裝置分離水和溴的苯溶液
C. 利用圖丙裝置蒸發KCl溶液得晶體
D. 圖丁裝置中溶液顏色變淺,說明SO2具有漂白性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com