
【題目】狼毒素來自香科植物,具有止痛、殺蟲的功效。N是合成狼毒素的重要中間體,其合成路線如下:
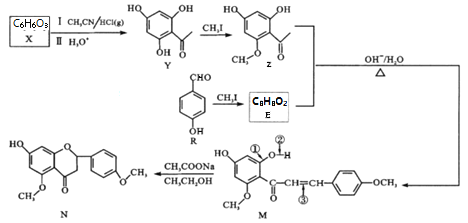
(1)R中含氧官能團名稱______;Y→Z的反應類型_______。
(2)1molZ與NaOH溶液反應,最多消耗NaOH為_____mol;反應R→E的化學方程式為_________。
(3)下列能測出N的相對分子質量的儀器是_____(填字母序號)。
A.元素分析儀 B.質譜儀 C.核磁共振儀 D.紅外光譜儀
(4)反應M→N中M的斷鍵位置為______(填數字序號)。
(5)同時滿足下列條件的Y的同分異構體有_____種。
①苯環上有3個取代基; ②為芳香族化合物且屬于酯類;
③遇氯化鐵溶液顯紫色; ④苯環上一氯代物有2種。
(6)以丙酮和![]() 為原料合成某有機中間體(
為原料合成某有機中間體( ),參照上述路線,設計路線__________________________。
),參照上述路線,設計路線__________________________。
【答案】 醛基、羥基 取代反應 2 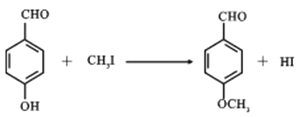 B ②③ 6
B ②③ 6 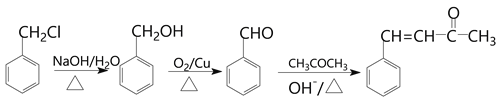
【解析】題目不要求X的相關問題,所以從Y開始推測。Y到Z發生取代反應,將Y中下方酚羥基的上的氫原子換成甲基,得到Z;則R發生相同的反應得到E(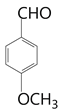 )。
)。
(1)R中含氧官能團為羥基和醛基。Y→Z的反應類型為取代反應。
(2)Z中有兩個酚羥基可以與氫氧化鈉中和,其余官能團都不反應,所以1molZ與NaOH溶液反應,最多消耗NaOH為2mol。反應R→E就是將羥基上的氫原子換成甲基,所以方程式為: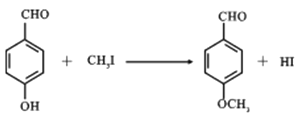 。
。
(3)物質分析中一般用質譜儀得到化合物的分子量,所以答案為B。元素分析儀是用來測定各元素含量的,核磁共振儀是測定氫原子的種類和數目的,紅外光譜儀是測定分子中的特定化學鍵或官能團的。
(4)M→N的反應類型為加成,用②處的氧和氫對③處的碳碳雙鍵進行加成,所以斷鍵位置為②③。參考下圖: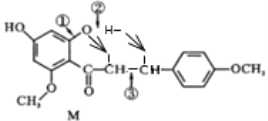
(5)Y的分子式為C8H8O4,根據題目的4個條件得到:分子有苯環,苯環上的三個取代基一定是兩個相同一個不同,且關于中間對稱。因為不可能有兩個酯基,所以只能是關于兩個酚羥基對稱,即可以是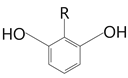 或
或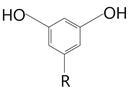 ,再考慮R中一定有酯基,且R中一共兩個碳,所以R可以是:-COOCH3、-CH2OOCH、-OOCCH3,即R一共有3種,則該有機物一共有6種。
,再考慮R中一定有酯基,且R中一共兩個碳,所以R可以是:-COOCH3、-CH2OOCH、-OOCCH3,即R一共有3種,則該有機物一共有6種。
(6)根據題目中的Z和E反應得到M的過程,將目標產物拆解為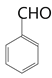 和
和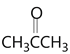 (丙酮)。將
(丙酮)。將![]() 水解再氧化就可以得到
水解再氧化就可以得到 ,所以流程圖為:
,所以流程圖為:


 小學教材全測系列答案
小學教材全測系列答案 小學數學口算題卡脫口而出系列答案
小學數學口算題卡脫口而出系列答案科目:高中化學 來源: 題型:
【題目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量與滴入NaOH溶液的體積關系如右圖所示,則原混合液中Al2(SO4)3與MgSO4的物質的量濃度之比為( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、Ti的單質及其化合物在現代社會有廣泛用途。
(1)基態鈦原子的電子排布式為________。
(2)CS2分子中含有σ鍵和π鍵之比為______;NO2+與CO2是等電子體,NO2+的電子式為___,鍵角為_______。
(3)CH3CHO沸點低于CH3CH2OH的原因是_____;CH3CHO分子中碳原子雜化類型為_____。
(4)鈦酸鋇(BaTiO3)晶體的某種晶胞如圖所示。NA為阿伏加德羅常數值,Ba2+、O2-、Ti4+的半徑分別為apm、bpm、cpm。

①與鋇離子等距離且最近的氧離子有______個;
②假設晶體中的Ti4+、Ba2+分別與O2-互相接觸,則該晶體的密度表達式為______g.cm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列電離方程式的書寫,正確的是
A. NH3·H2O==NH4+ + OH― B. H2SO4==2H+ + SO42―
C. CuCl2== Cu2+ + Cl― D. NaHCO3==Na+ + H+ + CO32―
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關離子檢驗的說法正確的是
A. 加入稀鹽酸產生無色氣體,氣體能使澄清石灰水變渾濁,原溶液中一定含有CO![]()
B. 加入稀鹽酸無明顯現象,再加入硝酸銀溶液產生白色沉淀,原溶液中一定含有Cl―
C. 加入BaCl2溶液產生白色沉淀,再加入稀鹽酸沉淀不溶解,原溶液中一定含有SO![]()
D. 加入KSCN溶液,呈現血紅色,原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把a,b,c三塊金屬片浸入稀硫酸中,用導線兩兩相連組成原電池。若a、b相連時,a為負極;b、c相連時,c不易被腐蝕。則三種金屬的活動性由強到弱的順序為
A. a>b>c B. a>c>b C. c>b>a D. b>c>a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】純堿是重要的化工原料,在醫藥、冶金、化工、食品等領域被廣泛使用。
I. 用純凈的碳酸鈉固體配制500mL 0.40mol/L Na2CO3溶液。
(1)稱取Na2CO3固體的質量是______________________g。
(2)配制溶液時,進行如下操作,按照操作順序,第4步是_________(填字母)。
a. 定容 b. 計算 c. 溶解 d. 搖勻 e. 轉移 f. 洗滌 g. 稱量
(3)下列說法中,正確的是_____________________(填字母)。
a. 定容時,仰視刻度線,會導致配制的溶液濃度偏小
b. 定容時,如果加水超過刻度線,要用滴管吸出
c. 轉移時,溶液倒出容量瓶外,要重新配制溶液
d. 搖勻后,液面低于刻度線,要再加水至刻度線
II. 某實驗小組的同學模擬侯德榜制堿法制取純堿,流程如下:

(1)工業生產純堿的第一步是除去飽和食鹽水的中SO42―、Ca2+離子,依次加入的試劑及其用量是 ______________、 _______________、 (過濾)、 _______________。
(2)已知:幾種鹽的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O時) | 36.0 | 21.7 | 9.6 | 37.2 |
①寫出裝置I中反應的化學方程式________________________________________。
②寫出裝置II中發生反應的化學方程式________________________________。
(3)該流程中可循環利用的物質是__________________。
(4)制出的純堿中只含有雜質NaCl。
①檢驗用該純堿配制的溶液中含有Cl―的方法是_________________________。
②測定該純堿的純度,下列方案中可行的是__________(填字母)。
a. 向m克純堿樣品中加入足量CaCl2溶液,沉淀經過濾、洗滌、干燥,稱其質量為b g
b. 向m克純堿樣品中加入足量稀鹽酸,用堿石灰(主要成分是CaO和NaOH)吸收產生的氣體,堿石灰增重b g
c. 向m克純堿樣品中加入足量AgNO3溶液,產生的沉淀經過濾、洗滌、干燥,稱其質量為b g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車凈化的主要原理為2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且說明反應在進行到t1時刻達到平衡狀態的是
2CO2(g)+N2(g) △H<0。若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且說明反應在進行到t1時刻達到平衡狀態的是
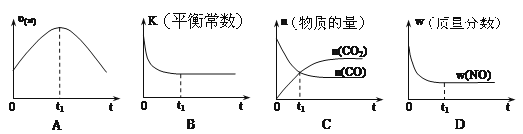
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com