
中和反應是放熱反應。取10 ml溶質質量分數為10%的NaOH溶液(密度1.10g/ml)置于燒杯中(并滴入2滴酚酞),向燒杯中逐滴加入稀鹽酸。隨著鹽酸的滴入,燒杯中溶液顏色從紅色逐漸變淺,當加入10 ml稀鹽酸時,溶液恰好變為無色。燒杯中溶液溫度與加入鹽酸體積之間關系如圖所示。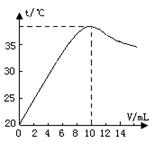
(1)當加入4ml稀鹽酸時,燒杯中溶液的溶質為
(寫化學式)
(2)試解釋燒杯中溶液溫度隨加入鹽酸的體積發生變化的
原因 。
(3)當鹽酸與氫氧化鈉恰好中和時生成氯化鈉多少克?
(精確到0.1g)
(1)NaOH NaCl
(2)中和反應放熱,隨著反應的進行,放出熱量增加,溶液溫度逐漸升高,加入10毫升稀鹽酸時恰好完全反應,溶液溫度最高。繼續加入鹽酸后,溶液被稀釋冷卻,溫度逐漸下降。
(3)1.6g
解析試題分析:
(1)由圖可知,當加入10毫升稀鹽酸時恰好完全反應,故加入4ml稀鹽酸時,氫氧化鈉過量,此時燒杯中溶液的溶質為NaOH和NaCl;
(3)根據質量守恒定律利用氫氧化鈉與氯化鈉的質量比即可求出氯化鈉的質量。
解:設生成氯化鈉的質量為x
NaOH + HCl = NaCl + H2O
40 58.5
1.1mL×1.1g/mL×10% x
40/( 1.1mL×1.1g/mL×10%)=58.5/x
x=1.6g
答:略
考點:中和反應、利用化學方程式的計算


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:計算題
某興趣小組的同學為了測定碳酸鈉樣品(只含有氯化鈉,不含其它雜質)中碳酸鈉的含量,取該混合物樣品與適量稀鹽酸恰好完全反應,有關實驗數據見附表.
附表:實驗數據
| | 反應前 | 反應后 | |||
| 實驗數據 | 燒杯的質量/g | 稀鹽酸的質量/g | 混合物樣品的質量/g | 燒杯和其中混合物的質量/g | |
| 40.6 | 123.4 | 12 | 171.6 | | |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(7分)學過金屬活動性后,秦思同學通過實驗探究鋅粉與硝酸亞鐵和硝酸銀兩種鹽溶液的反應。實驗現象和數據如下: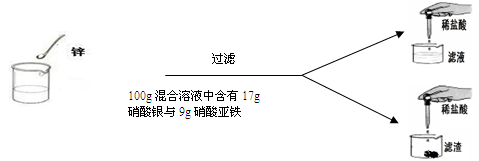
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 硝酸亞鐵與硝酸銀的混合溶液 | 100g | 100g | 100g | 100g |
| 鋅粉 | 2g | 3.25g | m | 9.75g |
| 向濾液中加入稀鹽酸后的實驗現象 | 產生白色沉淀 | 無明顯現象 | 無明顯現象 | 無明顯現象 |
| 向濾渣中加入100 g稀鹽酸后的實驗現象 | 無明顯現象 | 無明顯現象 | 產生氣泡,溶液變為淺綠色 | 現象與第三次相同 |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(3分)某化學興趣小組的同學對一份固體樣品進行了探究。通過實驗已確定該樣品由氧化鐵和鐵粉混合而成。他們稱取了13.6g固體樣品,用圖1所示的裝置繼續實驗,測定的部分數據如圖2所示。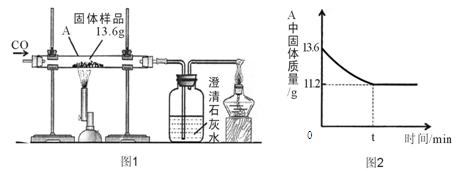
請計算:固體樣品中氧化鐵的質量是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(7分))課外活動時,同學們采用以下兩種方法測定某氯化鈉溶液的溶質質量分數。
(1)【化學方法】向一定量氯化鈉溶液中加入足量硝酸銀溶液,得到2.87g氯化銀固體,則該氯化鈉溶液中氯化鈉的質量為多少?(根據化學方程式列式計算)
經多次實驗測定,該溶液的溶質質量分數為10%。
(2)【物理方法】取一定量該溶液進行蒸發,測量實驗數據如下:
| 蒸發皿的質量(g) | 25.0 |
| 蒸發皿+食鹽溶液(g) | 45.0 |
| 蒸發皿+食鹽晶體(g) | 27.4 |
| 數據處理 | 溶液的溶質質量分數為 |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(3分)電動自行車、小汽車等交通工具中都有為其提供電能的鉛蓄電池(又稱“電瓶”),它的優點是可以充電循環使用,電瓶內發生的化學反應是:
PbO2(固)+ 2H2SO4 + Pb = 2PbSO4↓+ 2H2O
某電瓶中裝有36%的稀硫酸1200 g,電瓶工作時有310.5 g的鉛參加反應。試計算:
(1)原稀硫酸中所含溶質的質量是 g。
(2)電瓶工作時消耗硫酸的質量。
(3)反應后硫酸溶液中溶質的質量分數。(最后結果精確到0.01%)
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(6分)為了測定某品牌小蘇打樣品中碳酸氫鈉的質量分數,興趣小組進行了如下圖所示的實驗(假設該樣品中只含有氯化鈉一種雜質)。
請計算:
生成CO2氣體的質量;
樣品中碳酸氫鈉的質量分數。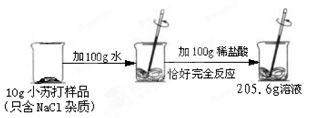
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(6分)黃銅(由銅和鋅形成的合金)有較強的耐磨性能、可塑性好、易加工,在生活中有廣泛的用途,可以制作機器零件、儀表等.某同學為了測定某黃銅屑樣品的組成,分四組取樣品與稀硫酸反應,其實驗數據記錄如下表: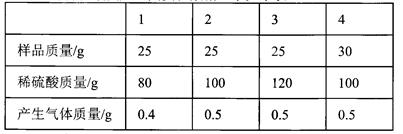
(1)通過分析上述數據可知,第 實驗黃銅樣品和稀硫酸恰好完全反應;
(2)黃銅合金中鋅的質量為 g
(3)列式計算所用稀硫酸中硫酸的質量分數?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com