解:(1)先根據公式m=ρv計算出所給8ml鹽酸的質量=1.2g/cm
3×8ml=9.6g
再根據溶液稀釋前后溶質質量不變即:稀釋前溶液質量×稀釋前溶質質量分數=稀釋后溶液質量×稀釋后溶質質量分數,
設需10%的鹽酸質量為y,
根據:稀釋前溶液質量×稀釋前溶質質量分數=稀釋后溶液質量×稀釋后溶質質量分數可知:9.6×36.5%=10%y
解得:y=35
稀鹽酸配制過程中用到的實驗儀器為:膠頭滴管、燒杯、玻璃棒和量筒可知,答案為:量筒
故答案為:35 量筒
(2)①、書寫方程式時根據R的化合價為+2,可得方程式為:RO+2HCl=H
2O+RCl
2
故答案為:RO+2HCl=H
2O+RCl
2
②、由①可知:化學方程式為:
RO+2HCl=H
2O+RCl
273 18
14.6×10% x
可得:
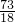
=
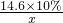
故答案為:
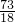
=
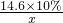
③、設R的相對原子質量為a,根據化學方程式:
RO+2HCl=H
2O+RCl
2a+16 73
1.6 14.6×10%
可得:

=
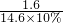
解得:a=64
可知R為銅
故選CuO
④、由③可知,R為銅,故化學方程式為:CuO+2HCl=H
2O+CuCl
2設生成CuCl
2為b
CuO+2HCl=H
2O+CuCl
273 135
14.6×10% b
可得:
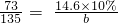
∴b=2.7
根據質量守恒定律 生成氯化銅溶液的質量=氧化銅質量+鹽酸質量=1.6+14.6=16.2
所以添加水后氯化銅溶液的總質量=16.2+118.8=135
所以氯化銅溶液中溶質質量分數=
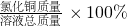
=
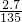
×100%=2%
故答案為:2%
分析:(1)先根據公式m=ρv計算出所給8ml鹽酸的質量,再根據溶液稀釋前后溶質質量不變的原則即可求解;
(2)①書寫方程式時要注意R的化合價;
②③根據化學方程式的計算可得出答案;
④反應后的溶液為氯化銅溶液,溶質氯化銅的質量可根據化學方程式計算,溶液總質量為化學反應中生成的溶液質量+產生水的質量.
點評:本題考查有關化學方程式的簡單計算.

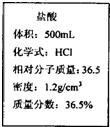 現有一瓶濃鹽酸,標簽如圖所示,請根據標簽上的數據回答問題:
現有一瓶濃鹽酸,標簽如圖所示,請根據標簽上的數據回答問題: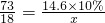
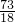 =
=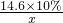
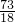 =
=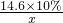
 =
=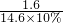
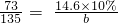
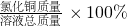 =
=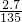 ×100%=2%
×100%=2%

 閱讀快車系列答案
閱讀快車系列答案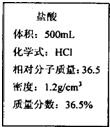 現有一瓶濃鹽酸,標簽如圖所示,請根據標簽上的數據回答問題:
現有一瓶濃鹽酸,標簽如圖所示,請根據標簽上的數據回答問題: