
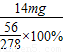 =69.5mg
=69.5mg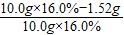 ×100%=5%<10%,不超過(guò)國(guó)家規(guī)定該片劑中Fe2+變質(zhì)超過(guò)10.0%的規(guī)定,可服用
×100%=5%<10%,不超過(guò)國(guó)家規(guī)定該片劑中Fe2+變質(zhì)超過(guò)10.0%的規(guī)定,可服用


| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:初中化學(xué) 來(lái)源: 題型:
查看答案和解析>>
科目:初中化學(xué) 來(lái)源:滬教版九年級(jí)上《3.3 物質(zhì)的組成》課時(shí)訓(xùn)練(3)(解析版) 題型:解答題
查看答案和解析>>
科目:初中化學(xué) 來(lái)源:2007年江蘇省南通市中考化學(xué)試卷(解析版) 題型:解答題
查看答案和解析>>
科目:初中化學(xué) 來(lái)源:江蘇中考真題 題型:計(jì)算題
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com