

 CaO +CO2↑或CaCO3 +2HCl = CaCl2 +H2O +CO2↑
CaO +CO2↑或CaCO3 +2HCl = CaCl2 +H2O +CO2↑ 2MgO + C 支持燃燒的不只有氧氣,二氧化碳也能支持燃燒 (或鎂著火時,不能用二氧化碳滅火等)
2MgO + C 支持燃燒的不只有氧氣,二氧化碳也能支持燃燒 (或鎂著火時,不能用二氧化碳滅火等) CaO +CO2↑;也可以是石灰石和稀鹽酸反應,生成氯化鈣、水和二氧化碳,故反應的化學方程式為CaCO3 +2HCl = CaCl2 +H2O +CO2↑。
CaO +CO2↑;也可以是石灰石和稀鹽酸反應,生成氯化鈣、水和二氧化碳,故反應的化學方程式為CaCO3 +2HCl = CaCl2 +H2O +CO2↑。 2MgO + C;由此可知,燃燒可以不需要氧氣,即支持燃燒的不只有氧氣,二氧化碳也能支持燃燒。
2MgO + C;由此可知,燃燒可以不需要氧氣,即支持燃燒的不只有氧氣,二氧化碳也能支持燃燒。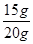 ×100%=75%
×100%=75%

 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源:不詳 題型:計算題
| 序號 | 加入稀鹽酸質量(g) | 剩余固體質量(g) |
| 第1次 | 100 | 60 |
| 第2次 | 100 | m |
| 第3次 | 100 | 12 |
查看答案和解析>>
科目:初中化學 來源:不詳 題型:計算題
| 實驗次數 | 一 | 二 | 三 | 四 |
| 固體混合物的質量(g) | 20 | 20 | 20 | 20 |
| 加入NaOH溶液的質量(g) | 20 | 40 | 60 | 80 |
| 生成沉淀的質量(g) | 2.9 | m | 8.7 | 8.7 |
查看答案和解析>>
科目:初中化學 來源:不詳 題型:計算題
| 次數 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入鹽酸的質量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固體的質量/g | 30 | 25 | 20 | 15 | 15 |
查看答案和解析>>
科目:初中化學 來源:不詳 題型:計算題
查看答案和解析>>
科目:初中化學 來源:不詳 題型:計算題
 Mg + Cl2↑。如欲制得24 kg鎂,計算需要電解的氯化鎂的質量。
Mg + Cl2↑。如欲制得24 kg鎂,計算需要電解的氯化鎂的質量。查看答案和解析>>
科目:初中化學 來源:不詳 題型:單選題
查看答案和解析>>
科目:初中化學 來源:不詳 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com