
【題目】根據下列裝置圖,回答有關問題:

(1)實驗室里制取氣體時,根據_____、反應條件確定氣體發生裝置。完成下表:
氣體 | 氣體發生裝置 | 化學方程式 |
氧氣 | A | _____。 |
二氧化碳 | B | _____。 |
(2)十八世紀,瑞典化學家舍勒用如圖裝置制備氧氣,曲頸甑中裝有硝酸鉀與濃硫酸的混合物,置于火爐上加熱,產生的氧氣用動物膀胱做成的口袋收集。若改用上圖中的發生裝置進行該實驗,最合適的是_____(填字母)。

(3)實驗室里用鋅粒與稀硫酸反應制取氫氣,以裝置B作為發生裝置,長頸漏斗的下端必須_____;以裝置D作為發生裝置,用分液漏斗添加稀硫酸的優點是_____,分液漏斗可以用_____替換。
(4)一定質量的鋅粒與98g質量分數為10%的稀硫酸恰好完全反應,最多生成氫氣的質量是多少_____?最后所得溶液的溶質質量分數是多少?_____(寫出計算過程)
【答案】反應物的狀態 2KMnO4![]() K2MnO4+MnO2+O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ C 伸入液面下 控制反應速率(合理即可) 注射器(合理即可) 0.2 15.4%
K2MnO4+MnO2+O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ C 伸入液面下 控制反應速率(合理即可) 注射器(合理即可) 0.2 15.4%
【解析】
(1)發生裝置的選擇依據反應物的狀態和反應條件,A裝置是固體加熱制取氧氣,由于裝置的試管口有一團棉花,因此是高錳酸鉀制氧氣,高猛酸鉀加熱生成錳酸鉀、二氧化錳和氧氣,方程式為:2KMnO4![]() K2MnO4+MnO2+O2↑;實驗室利用石灰石或大理石制取二氧化碳,石灰石的主要成分是碳酸鈣,碳酸鈣和稀鹽酸反應生成氯化鈣、水和二氧化碳,方程式為:CaCO3+2HCl=CaCl2+H2O+CO2↑;
K2MnO4+MnO2+O2↑;實驗室利用石灰石或大理石制取二氧化碳,石灰石的主要成分是碳酸鈣,碳酸鈣和稀鹽酸反應生成氯化鈣、水和二氧化碳,方程式為:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)曲頸甑中裝有硝酸鉀與濃硫酸的混合物,置于火爐上加熱,反應物是固體和液體,反應條件是加熱,因此發生裝置選擇C;
(3)裝置B作為發生裝置,長頸漏斗的下端必須浸沒在液面以下形成液封,防止生成的氣體從長頸漏斗下端逸出,以裝置D作為發生裝置,用分液漏斗添加稀硫酸的優點是可以控制反應速率,分液漏斗可以用注射器替換。
(4)設生成氫氣質量為x,生成硫酸鋅質量為
![]()
98 161 2
98g×10% y x
![]()
解得:x=0.2g; y=16.1g
所得溶液的溶質質量分數為:![]()
故答案為:(1)反應物的狀態; 2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)C
(3)浸沒在液面以下; 控制反應速率 (合理即可); 注射器(合理即可)
(4)0.2; 15.4%


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:初中化學 來源: 題型:
【題目】某化學興趣小組同學進行如下實驗探究。
(一)實驗室常用的制取氣體的裝置如下:
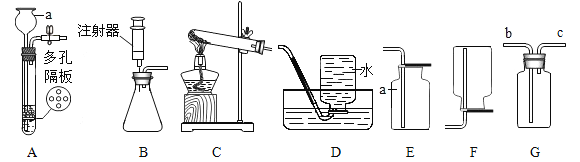
(1)儀器 a 的名稱_________。
(2)實驗室制二氧化碳的反應方程式為________________________________,該反應屬于________________(填寫基本反應類型)
(3)實驗室用過氧化氫溶液和二氧化錳粉末混合制取氧氣,選用的裝置組合可以是______,裝置B中注射器的作用是______________。
(4)若用G裝置收集氧氣,寫出驗滿的方法____________________,用制得的氧氣做鐵絲燃燒實驗時沒看見火星四射,原因可能是 _____________________。
(5)某同學用一定濃度鹽酸與石灰石在一個密閉性良好的裝置里反應,將生成的氣體通入澄清石灰水中,始終未見渾濁,造成此現象的可能原因:______________________________
(二) 碘化鉀(KI)是白色固體,保存不當會被氧化為單質碘(I2)而泛黃變質。化學小組查得以下資料:
Ⅰ.對于碘化鉀變質的原理,有兩種不同的反應:
甲:4KI + O2 + 2CO2 == 2K2CO3 + 2I2
乙:4KI + O2 + 2H2O == 4KOH + 2I2
Ⅱ.KOH與NaOH的化學性質相似。
為探究碘化鉀變質原理的合理性,開展以下實驗。
(實驗過程)
[實驗1]取適量碘化鉀固體暴露于空氣中一段時間,觀察到固體泛黃。往泛黃的固體中加入足量稀硫酸,產生無色無味的氣體,通入澄清石灰水中,澄清石灰水變渾濁。
① 石灰水變渾濁的原因是_______________________________(用化學方程式表示)。
② 化學小組認為:據此現象,還不能得出“反應甲是造成碘化鉀變質的原因”的結論。理由是____________________________________。
[實驗2]如下圖所示裝置進行實驗,數日后,觀察到碘化鉀固體無泛黃現象。
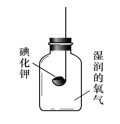
③ 據此現象,可得出的結論是_____________________________ 。
[實驗3]按下圖所示裝置進行實驗,數日后,觀察到碘化鉀固體無泛黃現象。查閱文獻獲知,常溫下某些氣體和固體反應須在潮濕環境中進行。
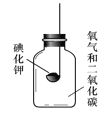
化學小組據此改進實驗,很快觀察到固體泛黃的現象。
(實驗結論)④ 根據上述實驗,化學小組得出結論,碘化鉀固體泛黃變質是碘化鉀與_______________共同作用的結果。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】自來水消毒過程中通常會發生如下化學反應,其反應的微觀過程可用如圖表示:
(![]() 表示氯原子,
表示氯原子,![]() 表示氧原子,
表示氧原子,![]() 表示氫原子)
表示氫原子)
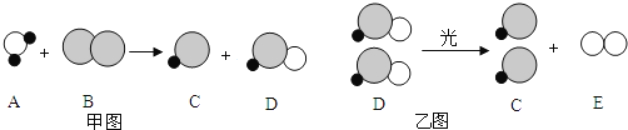
(1)請寫出甲圖所示反應的化學方程式_____;
(2)乙圖所示反應的基本反應類型為_____;
(3)上述物質中,屬于單質的有_____(填化學式);
(4)以甲圖為例分析,你能總結出的一條結論是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某氫氧化鈉樣品中混有氯化鈉,為測定樣品中氫氧化鈉的質量分數,稱取5 g樣品,加入27 g水完全溶解后,緩慢加入稀鹽酸,同時測定溶液的pH。當pH=7時,剛好用去10%的稀鹽酸36.5 g。試計算:
(1)將100 g質量分數為38%的濃鹽酸稀釋成10%的稀鹽酸,需加水的質量為 g。
(2)樣品中氫氧化鈉的質量分數。
(3)反應后所得溶液中溶質的質量分數。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】已知鋁在空氣中會生成一層致密的氧化膜(Al2O3 ),該氧化膜可與稀鹽酸發生反應:Al2O3+6HCl===2AlCl3+3H2O。實驗小組將未打磨的鋁片和稀鹽酸放入密閉容器中,用傳感器探究反應過程中溫度和壓強的變化,結果如右圖。下列說法不正確的是 ( )
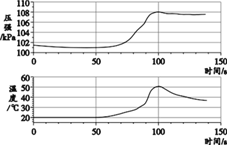
A. 反應過程中有熱量放出
B. 0~50 s,發生稀鹽酸與 Al2O3 的反應
C. 50 s 時,溶液中溶質為 AlCl3
D. 100 s~140 s,壓強減小是因為溫度降低
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】從古代到現代,材料的種類越來越多,用途也越來越廣泛。請回答:
(1)早在西漢時期,我國就有濕法煉銅的記載,將鐵置于硫酸銅溶液中得到銅單質,該反應屬于_______________(填基本反應類型)。
(2)現代社會,玻璃是一種常見的非金屬材料,SiO2是生產玻璃的原料之一。SiO2屬于___________(選填“酸”、“ 堿”、“ 鹽”或“氧化物”)。
(3)未來,人類在生產材料時會更注重環境保護,將二氧化碳作為原料應用于“綠色”化學可以更好地保護環境。人類每年因能源消費而向大氣排放約200億噸的CO2,若這些CO2按化學方程式“CO2+3H2![]() CH3OH+H2O”"進行反應,理論上可以轉化為_______億噸甲醇[CH3OH](結果保留一位小數)。
CH3OH+H2O”"進行反應,理論上可以轉化為_______億噸甲醇[CH3OH](結果保留一位小數)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】從海水中得到的粗鹽中往往含有可溶性雜質(主要有Na2SO4、MgCl2、CaCl2)和不溶性雜質(泥沙等),必須進行分離和提純后才能使用。粗鹽提純的部分流程如圖。有關該流程說法錯誤的是( )

A. 不溶性雜質主要是泥沙
B. 過濾時玻璃棒的作用是攪拌,以便加快過濾速度
C. 蒸發時,當蒸發皿中出現較多固體時,停止加熱,利用蒸發皿的余熱使濾液蒸干
D. 操作①②③依次加入的試劑可以為BaCl2溶液、NaOH溶液、Na2CO3溶液
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某工廠從含銅廢料中回收銅的生產流程如下.(提示:銅灼燒后的固體可以與稀硫酸反應生成硫酸銅和水;含銅廢料中,除銅外其余物質不與氧氣或稀硫酸反應且不溶于水。)

(1)“酸浸”步驟需加熱。寫出該步驟發生反應的化學方程式____________________。
(2)操作Ⅰ的名稱是________,經操作Ⅰ分離所得溶液中含有的微粒有_______(填微粒符號)和H2O。
(3)過量試劑X與操作Ⅰ分離所得溶液發生反應,寫出相關的化學方程式:____________。
(4)請補充完整由固體物質Y得到銅粉的實驗方案:向固體物質Y中_____________,用水洗滌固體2~3次,干燥得到銅粉。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某環保小組監測到一工廠向河水中排放的廢液中含有CuSO4和H2SO4。
(1)CuSO4是重金屬鹽,能與蛋白質發生______變化(選填“物理”或“化學”),使蛋白質失去原來的生理功能,所以CuSO4有毒。
(2)為了測定廢液中CuSO4的質量分數,該小組取100g廢液,逐滴加入NaOH溶液至過量。測得生成Cu(OH)2沉淀的質量與所加NaOH溶液的質量關系如圖所示:

①實驗最終生成Cu(OH)2沉淀的質量是_____g,圖中OA段未生成Cu(OH)2沉淀的原因:______。
②計算廢液中CuSO4的質量分數(結果精確到0.1%)。_____(已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4)
③若另取l00g廢液,向其中逐滴加入過量的BaCl2溶液充分反應后,將生成的沉淀過濾、洗滌、干燥,最后稱得質量為mg,則_____ (填“能”或“不能”)用含m的代數式表達廢液中CuSO4的質量分數。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com