
(9分)醫用二水合氯化鈣可用于補鈣、抗過敏和消炎等,以某碳酸鈣樣品(其中含少量Al3+、Fe3+等雜質)生產醫用二水合氯化鈣的工藝流程為: (已知二水合氯化鈣在溫度超過160°C時分解為氯化鈣和水)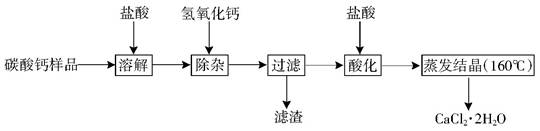
已知:查閱資料得知氫氧化物沉淀及溶解時的pH為:
| 氫氧化物 | Fe(OH)3 | Al(OH)3 | |
| 開始沉淀時的pH | 2.3 | 4.0 | 開始溶解:7.8 |
| 完全沉淀時的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(1)加快溶解(速度),漏斗
(2)5.2<X<7.8(或5.2-7.8); Fe(OH)3、Al(OH)3(少一種不給分)
(3)除去過量的氫氧化鈣[(Ca(OH)2 或OH-];
(4)防止二水合氯化鈣分解(或防止產物分解)
(5)80%
解析試題分析:(1)溶解時玻璃棒的作用是加快固體物質的溶解速度;過濾時用到的玻璃儀器有燒杯、玻璃棒和漏斗。
(2)根據表格中的數據可知:Fe(OH)3完全沉淀時的pH為3.7;Al(OH)3完全沉淀時的pH為5.2;但當PH 為7.8時 Al(OH)3開始溶解。所以要使Al3+、Fe3+全部轉化為沉淀,需要將溶液的的pH控制在5.2-7.8。濾渣A的主要成分為Fe(OH)3 、Al(OH)3
(3)因除雜時為將兩種離子全部沉淀,需要加入過量的氫氧化鈣,所以酸化時加鹽酸的主要目的為了除去過量的氫氧化鈣[(Ca(OH)2 或OH-]。
(4)根據題意可知:二水合氯化鈣在溫度超過160°C時分解為氯化鈣和水。為防止二水合氯化鈣分解(或防止產物分解)所以蒸發結晶時,必須控制溫度低于160℃。
(5)已知量為氯化鈣11.1Kg;未知量為樣品中碳酸鈣的質量分數。解題思路:可根據氯化鈣和碳酸鈣在反應中的質量關系求出碳酸鈣的質量,再進一步求出碳酸鈣的質量分數。具體過程如下:
解:設CaCO3最大質量為x
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 111
x 11.1kg
100:111=x:11.1kg
x=10kg 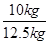 ×100%=80%
×100%=80%
答:樣品中碳酸鈣的質量分數最大為80%
考點:工藝流程圖、綜合計算


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:計算題
(14分)化學是研究物質的組成、結構、性質及變化規律的科學。
(1)①銅、②干冰、③氯化鈉三種物質中,由離子構成的是 (填寫序號,下同),可用于人工降雨的是 。
(2)食醋中含有醋酸(CH3COOH),醋酸由 種元素組成,其分子中氫、氧原子個數比為 。
(3)氣體A和氣體B接觸可發生反應,生成固體C和液體D,其微觀過程如下所示。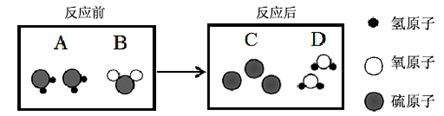
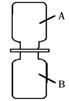
圖1 圖2
① 該反應過程中,屬于氧化物的是 (填名稱)。
② 將等體積的兩只集氣瓶中分別盛滿A、B,如圖2所示進行實驗。已知相同條件下,氣體的體積比等于分子個數比, 則充分反應后,剩余的氣體是 (填化學式)。
(4)造紙會產生大量含NaOH的堿性廢水,需經處理呈中性后排放。
① 用pH試紙檢測廢水呈堿性的方法是 。
② 若某造紙廠廢水中含NaOH的質量分數為l.6%,現有廢硫酸9.8t(H2SO4的質量分數為20%),可以處理的廢水質量是多少?(寫出計算過程)
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(7分))課外活動時,同學們采用以下兩種方法測定某氯化鈉溶液的溶質質量分數。
(1)【化學方法】向一定量氯化鈉溶液中加入足量硝酸銀溶液,得到2.87g氯化銀固體,則該氯化鈉溶液中氯化鈉的質量為多少?(根據化學方程式列式計算)
經多次實驗測定,該溶液的溶質質量分數為10%。
(2)【物理方法】取一定量該溶液進行蒸發,測量實驗數據如下:
| 蒸發皿的質量(g) | 25.0 |
| 蒸發皿+食鹽溶液(g) | 45.0 |
| 蒸發皿+食鹽晶體(g) | 27.4 |
| 數據處理 | 溶液的溶質質量分數為 |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(5分)某石灰廠為了測定一批石灰石樣品中碳酸鈣的質量分數,取用4 g石灰石樣品,把20 g稀鹽酸分4次加入樣品中(樣品中除碳酸鈣外,其余的成分既不與鹽酸反應,也不溶于水),充分反應后經過濾、干燥等操作,最后稱量,得實驗數據如下表:
| 次數 | 第一次 | 第二次 | 第三次 | 第四次 |
| 稀鹽酸的用量 | 5 g | 5 g | 5g | 5g |
| 剩余固體的質量 | 3 g | 2 g | 1 g | 1 g |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(6分)為了測定某品牌小蘇打樣品中碳酸氫鈉的質量分數,興趣小組進行了如下圖所示的實驗(假設該樣品中只含有氯化鈉一種雜質)。
請計算:
生成CO2氣體的質量;
樣品中碳酸氫鈉的質量分數。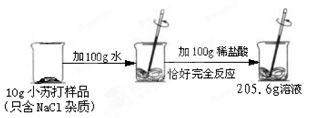
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(4分)我國約在南北朝時就開始煉制黃銅,黃銅是銅和鋅的合金,它可用來制造機器、電器零件及日用品,為了測定某黃銅中銅的質量分數,取10g黃銅加入到50g稀硫酸中,恰好完全反應,產生氫氣0.1g,試求:
(1)該黃銅樣品中銅的質量分數。
(2)原稀硫酸溶液中溶質的質量分數。
(溫馨提示:解答時,要有必要的文字說明和計算步驟等,只寫最后結果不給分)
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(3分)硅(Si)是太陽能電池和電腦芯片中不可缺少的材料。硅生產過程中的一個重要化學反應為SiO2 + 2C 高溫 Si + 2CO↑。若生產5.6 g硅,理論上需要二氧化硅(SiO2)多少克?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
某同學為了檢驗家里購買的硫酸銨化肥是否合格,他稱取27.5 g化肥樣品與足量濃燒堿溶液加熱,產生的氨氣用100.0g廢硫酸吸收。測得吸收氨氣的溶液總質量m與反應時間t的變化如下圖所示。所涉及的反應為: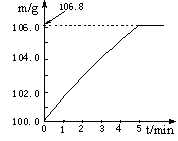
(NH4)2SO4+2NaOH Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
請計算:
(1)完全反應后產生氨氣 g。
(2)該化肥的含氮量為 (精確到0.1%),則這種化肥屬于 (填:“合格”或“不合格”。合格硫酸銨含氮量為20%以上)產品。
(3)請計算廢硫酸中硫酸的質量分數(寫出計算過程)。
(4)若實驗過程中氨氣被完全吸收,但該實驗測得硫酸銨化肥的含氮量高于實際值,其原因是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com