
題目列表(包括答案和解析)
(本題共10分)
亞硝酰氯(NOCl)是有機合成中的重要試劑,可由NO與Cl2在通常條件下反應得到(NO2與Cl2反應可得硝酰氯)。亞硝酰氯的熔點為-64.5 ℃,沸點為-5.5 ℃,并且遇水蒸氣分解為氮的氧化物和氯化氫。
某校化學興趣小組按如下流程制備亞硝酰氯,實驗時,先通入Cl2,待E中U形管內(nèi)充滿黃綠色氣體時,再緩緩通入NO。“→”表示氣流方向。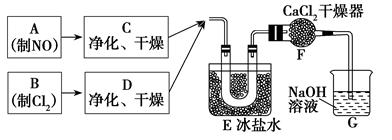
34.實驗室用氯酸鉀和濃鹽酸制備Cl2的化學方程式是______________________________。
35.裝置F的作用是___________________________________。
36.亞硝酰氯與水反應的化學方程式是________________________________。
37.實驗中“先通入Cl2,待E中U形管內(nèi)充滿黃綠色氣體時,再將NO緩緩通入”,此操作的目的是______________________________________________________________。
(本題共10分)
亞硝酰氯(NOCl)是有機合成中的重要試劑,可由NO與Cl2在通常條件下反應得到(NO2與Cl2反應可得硝酰氯)。亞硝酰氯的熔點為-64.5 ℃,沸點為-5.5 ℃,并且遇水蒸氣分解為氮的氧化物和氯化氫。
某校化學興趣小組按如下流程制備亞硝酰氯,實驗時,先通入Cl2,待E中U形管內(nèi)充滿黃綠色氣體時,再緩緩通入NO。“→”表示氣流方向。

34.實驗室用氯酸鉀和濃鹽酸制備Cl2的化學方程式是______________________________。
35.裝置F的作用是___________________________________。
36.亞硝酰氯與水反應的化學方程式是________________________________。
37.實驗中“先通入Cl2,待E中U形管內(nèi)充滿黃綠色氣體時,再將NO緩緩通入”,此操作的目的是______________________________________________________________。

非金屬知識規(guī)律總結
【高考導航】
一、非金屬元素在周期表中的位置和結構特點
1、除H外,非金屬元素均在“階梯線”的右上方。共有16種非金屬元素,其中包括稀有氣體元素6種。
2、非金屬元素(包括稀有元素)均在主族(零族)。非金屬元素一般都有變價。
3、最外層電子數(shù)一般≥4(H、B除外)。
4、原子半徑比同周期金屬半徑小(稀有元素除外)。
二、非金屬性強弱的判斷依據(jù)
元素非金屬性的本質(zhì)是元素的原子吸引電子的能力。試題常通過以下幾個方面來比較元素的非金屬性:
1、單質(zhì)跟H2化合難易程度(反應條件,劇烈程度,反應熱的大小,生成氣態(tài)氫化物的穩(wěn)定性)。
2、最高價氧化物對應水化物的酸性。
3、化合物中元素化合價的正負,如BrCl中,Cl為-1價,Br為+1價,說明非金屬性Cl>Br。
4、通過氧化還原反應確定非金屬單質(zhì)的氧化能力,進而比較非金屬性。
需要指出的是,非金屬單質(zhì)的活動性與非金屬元素的活動性,有密切的聯(lián)系,但不是一回事。例如氮元素的非金屬性相當強,可是它的單質(zhì)N2化學性質(zhì)卻不很活潑。單質(zhì)的化學性質(zhì)不僅取決于原子結構,而且取決于分子結構和晶體結構。
三、非金屬元素的性質(zhì)及遞變規(guī)律
1、單質(zhì):
(1)結構:除稀有氣體外,非金屬原子間以共價鍵結合。非金屬單質(zhì)的成鍵有明顯的規(guī)律性。若它處在第N族,每個原子可提供8-N個價電子去和8-N個同種原子形成8-N個共價單鍵,可簡稱8-N規(guī)則;(H遵循2-N規(guī)則)。如ⅦA族單質(zhì):x-x;H的共價數(shù)為1,H-H,第ⅥA族的S、Se、Te共價單鍵數(shù)為8-6=2,第ⅤA族的P、As共價單鍵數(shù)8-5=3。但第二周期的非金屬單質(zhì)中N2、O2形成多鍵。
(2)熔沸點與聚集態(tài)。它們可以分為三類:
①小分子物質(zhì)。如:H2、O2、N2、Cl2等,通常為氣體,固體為分子晶體。
②多原子分子物質(zhì)。如P4、S8、As4等,通常為液態(tài)或固態(tài)。均為分子晶體,但熔、沸點因范德華力較大而比①高,Br2、I2也屬此類,一般易揮發(fā)或升華。
③原子晶體類單質(zhì)。如金剛石、晶體硅和硼等,是非金屬單質(zhì)中高熔點“三角區(qū)”,通常為難揮發(fā)的固體。
(3)導電性:非金屬一般屬于非導體,金屬是良導體,而鍺、硅、砷、硒等屬于半導體。但半導體與導體不同之處是導電率隨溫度升高而增大。
(4)化學活性及反應:

③非金屬一般為成酸元素,難以與稀酸反應。 固體非金屬能被氧化性酸氧化。

2、氫化物:
(1)氣態(tài)氫化物性質(zhì)比較
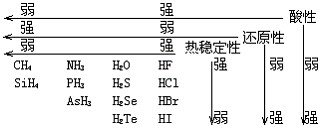
(2)由于氫鍵的存在,使得第ⅤA、ⅥA、ⅦA氫化物的熔沸點出現(xiàn)了反常。第ⅤA中:SbH3>NH3>AsH3>PH3;第ⅥA中: H2O>H2Te>H2Se>H2S;第ⅦA中HF>HI>HBr>HCl。
(3)氣態(tài)氫化物水溶液的酸堿性及與水作用的情況。①HCl、HBr、HI溶于水成酸且都是強酸。②HF、H2S、H2Se、H2Te溶于水成酸且都是弱酸。③NH3溶于水成堿,氨水是弱堿。④PH3、AsH3、CH4與水不反應。⑤SiH4、B2H6與水作用時分解并放出H2。
3、非金屬氧化物的通性:
(1)許多非金屬低價氧化物有毒,如SO2、NO、NO2、CO等,注意不能隨便排放于大氣中。
(2)非金屬氧化物(除SiO2外)大都是分子晶體,熔沸點相差不大。
(3)非金屬氧化物大都為酸酐,相應的酸易溶于水,則氧化物易與水化合,反之水化反應難以進行。
(4)不成鹽氧化物(如CO、NO)不溶于水,也不與堿反應。雖然NO2能與堿反應生成鹽,但NO2不屬于酸酐。
4、含氧酸
(1)同周期非金屬元素最高價含氧酸從左到右酸性增強。
(2)氧化性:同種元素低價強于高價含氧酸.
如:HClO>HClO3>HClO4(稀)
H2SO3>H2SO4(稀)
HNO2>HNO3(稀)
(3)對于同種非金屬形成的不同含氧酸,價態(tài)越高,酸性越強。其順序如:HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3。
(4)難揮發(fā)的H2SO4、H3PO4受熱難分解;強氧化性的HNO3、HNO2、HClO見光或受熱易分解;非氧化性的H2CO3、H2SO3易分解。強酸可制弱酸,難揮發(fā)性酸制揮發(fā)性酸。
(5)常見含氧酸的一般性質(zhì):
①H2SO4:無色粘稠的油狀液體,強酸,沸點高,不揮發(fā),穩(wěn)定。濃硫酸有吸水性、脫水性和強氧化性。
②H2SO3:僅存在于溶液中,中強酸,不穩(wěn)定。
③HClO4:在水溶液中相當穩(wěn)定,最強無機酸,有強氧化性。
④HClO:僅存在于溶液中,是一種弱酸,有強氧化性和漂白性,極不穩(wěn)定,遇光分解。⑤HNO3:無色液體,強酸,沸點低,易揮發(fā),不穩(wěn)定,易分解,有強氧化性。
⑥H3PO4:無色晶體,中強酸,難揮發(fā),有吸水性,穩(wěn)定,屬于非氧化性酸。
⑦H2CO3:僅存在于溶液中,弱酸,不穩(wěn)定。
⑧H2SiO3:白色固體,不溶于水,弱酸,不揮發(fā),加熱時可分解。
⑨常見酸的酸性強弱。強酸:HCl、HNO3、H2SO4;中強酸:H2SO3>H3PO4(H3PO4中強偏弱);弱酸:HF>CH3COOH>H2CO3>H2S>HClO>H2SiO3。
四、11種無機化學氣體的制取和性質(zhì)(O2、H2、Cl2、CO、NO、SO2、NO2、CO2、H2S、HCl、NH3)。
(1)利用氧化還原反應原理制取的氣體有:O2、H2、Cl2、NO、NO2等。
(2)利用復分解制取的氣體有:SO2、CO2、H2S、HCl、NH3等。
(3)可用啟普發(fā)生器制取的氣體有:H2、CO2、H2S等。
(4)只能用排氣法收集的是:Cl2、SO2、NO2、CO2、H2S、HCl、NH3等。只能用排水法收集的氣體是:NO、CO。
(5)使紅色石蕊變藍的氣體是NH3;使石灰水變渾濁的氣體是SO2和CO2;使品紅溶液褪色的氣體是SO2和Cl2;使高錳酸鉀溶液和溴水褪色的氣體有H2S和SO2。
(6)臭雞蛋氣味的氣體是H2S;刺激性氣味的氣體有:Cl2、SO2、NO2、HCl、NH3等;毒性氣體有:Cl2、CO、NO、SO2、NO2、H2S等。
(7)能在空氣中燃燒的氣體:H2S、CO、H2等
化學方程式練習
一、用化學方程式表示下列各種物質(zhì)的實驗室制法
1、O2(三種方法):
2、H2:
3、Cl2:
4、NH3:
5、CO2:
6、NO:
二、用方程式表示工業(yè)生產(chǎn)過程(參考選修Ⅱ,帶*的寫離子方程式,注意反應條件)
1、氯堿工業(yè)(電解飽和食鹽水)
*陽極:
*陰極:
*總反應:
2、接觸法制硫酸(硫鐵礦為原料)
①沸騰爐: ;其中氧化產(chǎn)物為:
②接觸室: ;
V2O5的作用是 ,反應溫度控制在400~500℃的原因是
③吸收塔:
用98%H2SO4吸收SO3而不用水直接吸收的原因是
。
④尾氣處理:
3、海水提溴:
*①氯化:
②吹出
③吸收:
④轉(zhuǎn)化:
4、合成氨:
①由水和碳合成H2
②合成塔:
5、氨氧化制硝酸
①氧化爐:
②吸收塔:
③制取化肥硝酸銨:
6、冶煉鋁(冰晶石作熔劑)
①堿溶:
②沉淀:
③脫水:
④電解:*陽極:
*陰極:
總反應:
7、鋁熱法制鐵
8、由三氧化鎢制鎢
9、工業(yè)制漂白粉
10、制玻璃
11、工業(yè)生產(chǎn)石灰漿
12、聯(lián)合制堿法:
13、高純硅的生產(chǎn)
。
14、煉鐵煉鋼
①還原劑的生成:
;
②鐵的還原(將鐵的氧化物,如Fe2O3還原):
③將生鐵脫硫去磷降低含碳量即得鋼。
三、完成下列反應的化學方程式(注意寫反應條件)。
1、Fe + H2O(g)=
2、C+ H2O(g) =
3、CO+ H2O(g) =
4、F2+ H2O=
5、NH3+H2O
6、NO2+ H2O=
7、SO2+ H2O
8、Cl2 + H2O=
9、K + H2O=
10、Na2O2+ H2O=
11、CaC2+ H2O=
12、Mg3N2+ H2O =
13、Al + NaOH+ H2O=
14、CaCO3+ H2O+ CO2=
15、Fe(OH)2+ H2O+ O2=
16、FeCl3+ H2O
17、NH4Cl+H2O
18、Na2CO3+H2O
19、CuSO4+H2O電解
20、Na2S2O3 + HCl =
21、SiO2 + HF=
22、SiO2 + NaOH=
23、Na2SiO3+ HCl=
四、寫出下列物質(zhì)分別與NaOH溶液反應的化學方程式。
1、Si
2、Cl2
3、SiO2
4、SO2 (足量)
5、CO2(小量)
6、H3PO4
7、H2SO4
8、CH3Br
9、Al
10、Al2O3
11、AlCl3
12、Al(OH)3
13、CuSO4
14、NaHCO3
15、Ca(HCO3)2(足量)
16、(NH4)2SO4
五、寫出下列物質(zhì)受熱或光照的化學方程式。
1、NaHCO3
2、HNO3
3、AgBr
4、H2SO3
5、NH4HCO3
6、Cu(OH)2
7、Ca(HCO3)2
8、Cu2(OH)2CO3
9、H2O2
10、KClO3
11、KMnO4
12、NH4Cl
13、HClO
14、CH4+Cl2
15、H2+Cl2
16、CuO
六、寫出下列反應的化學方程式和離子方程式
1、SO2使溴水褪色:
2、SO2使酸性高錳酸鉀溶液褪色:
3、氫氧化鐵溶于氫碘酸:
4、乙二酸(草酸)使酸性高錳酸鉀溶液褪色 :
5、用石灰水與小蘇打溶液制燒堿:
6、硫酸氫銨與氫氧化鋇溶液混合:
7、漂白粉溶液中充入足量CO2:
8、KHSO4與氫氧化鋇溶液混合呈中性:
9、Fe3O4溶于稀硝酸:
10、明礬溶液中加Ba(OH)2溶液至沉淀量最大:
七、用離子方程式表示下列在溶液中的反應
1、KCl+AgNO3:
2、Ba(OH)2+H2SO4:
3、BaCO3+HCl:
4、Cu(OH)2+HCl:
5、Fe(OH)2+HNO3(稀) :
6、FeCl3+KSCN:
7、FeBr2+Cl2(物質(zhì)的量之比為1:1):
8、NaBr+Cl2:
9、Fe+CuCl2:
10、Zn+AgNO3:
11、純堿水解:
12、明礬凈水:
13、銅和稀硝酸:
14、配制銀氨溶液:
15、Na2O2投入稀硫酸中:
八、寫出下列物質(zhì)在空氣中變質(zhì)的化學方程式
1、Na2SO3:
2、NaOH:
3、NO:
4、Na:
5、Na2O2:
6、銅生銹:
7、氯水:
8、白磷:
9、稀硫酸酸化的FeSO4溶液變棕黃色
10、無色KI溶液變棕黃色
11、漂白粉失效:
九、寫出下列反應的化學方程式
1、混合H2S和SO2生成硫和水:
2、炭加熱放入濃硫酸中:
3、乙醇催化氧化為乙醛:
4、乙醛與銀氨溶液反應:
5、乙醛與新制Cu(OH)2加熱:
6、銅與濃硫酸共熱:
7、氧化硫通入濃溴水:
8、銅與濃硝酸反應:
9、木炭和濃硝酸共熱:
10、FeCl3溶液中加入KI溶液:
11、高錳酸鉀固體中滴入濃鹽酸:
12、氨水通入少量SO2:
13、偏鋁酸鈉溶液中加足量稀硫酸:
14、NaAlO2溶液中充入足量CO2:
15、Ba(AlO2)2溶液中加入硫酸鋁溶液:
16、氫氧化亞鐵水溶液在空氣中變質(zhì):
12、氯化鐵溶液溶解銅:
十、按要求寫方程式
1、寫出高溫條件下發(fā)生的置換反應四個:
①
②
③
④
2、寫出一個點燃條件下的置換反應:
3、寫出一個加熱條件下的置換反應:
4、寫出一個有三種反應物的置換反應:
5、寫出工業(yè)生產(chǎn)中需要高溫條件的反應(不少于5個)的化學方程式:
6、試設計一個實驗,檢驗某溶液中存在Fe2+,請在下面的橫線上按操作順序?qū)懗鱿鄳碾x子方程式: 。
7、治療胃酸過多的藥物中常用Al(OH)3,如何用氧化鋁制取氫氧化鋁?要求制取過程中酸堿的用量降到最少。按生產(chǎn)順序?qū)懗鱿嚓P的離子方程式: 。
8、化學反應中有的具有相似性,有的反應具有特殊性,試寫出下列相關化學方程式,并思考其中的原因:
① Li + O2
Na + O2
② Mg + CO2
Mg + SO2
③ Na2O2 + CO2
Na2O2 + SO2
KO2 + CO2
④ F2 + H2O
Cl2 + H2O
⑤ Fe + Cl2
Fe + I2
⑥ Fe(OH)3 + HCl
Fe(OH)3 + HI
9、按要求寫化學方程式
①堿性氧化物與水反應(舉2例)
②堿性氧化物與酸反應(舉2例)
③金屬氧化物但不是堿性氧化物的氧化物與水反應(舉一例)
④酸性氧化物與水反應(舉2例,其中一例為金屬氧化物)
⑤能與水反應生成酸,但不是酸性氧化物也不是堿性氧化物氧化物與水反應的化學方程式:
。
⑥列舉不少于5類既能與強酸反應,又能與強堿反應的物質(zhì),并分別寫出它們與酸(HCl)、堿(NaOH)反應的離子方程式:
A、物質(zhì)化學式:
B、物質(zhì)化學式:
C、物質(zhì)化學式:
D、物質(zhì)化學式:
E、物質(zhì)化學式:
F、物質(zhì)化學式:
G、物質(zhì)化學式:
10、某酸性氧化物,它能與某些酸反應,也能與堿反應,請寫出這樣的氧化物一種,并寫出它與酸反應的化學方程式和與堿反應的離子方程式:
氧化物分子式:
一、選擇題(每小題3分,共30分。每小題只有一個正確選項)
題號
1
2
3
4
5
6
7
8
9
10
答案
B
B
D
A
C
C
C
A
D
B
二、選擇題(每小題2分,共18分。每小題只有一個正確選項)
題號
11
12
13
14
15
16
17
18
19
答案
B
D
C
B
A
C
D
A
D
三、(共23分)
20.(12分)
第一學期期末檢測高三化學.files/image037.jpg) |
(1)
(2)NH3?H2O第一學期期末檢測高三化學.files/image008.jpg) NH4++OH-(2分) (3)1∶1(2分)
NH4++OH-(2分) (3)1∶1(2分)
(4)①NH4++H2O第一學期期末檢測高三化學.files/image015.jpg) NH3?H2O+H+(2分)
NH3?H2O+H+(2分)
②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
21.(11分)
(1)bd(2分) (2)①25%(2分) 23.1 kJ(2分) ②>(2分)
(3)陰(1分) N2+6H++6e-=2NH3(2分)
四、(共11分)
22.(4分)
④②③⑤①(2分) Ag++Br-=AgBr↓(2分)
23.(7分)
(1)MnO2+4HCl(濃)第一學期期末檢測高三化學.files/image039.jpg) MnCl2+Cl2↑+2H2O(2分,合理答案給分)
MnCl2+Cl2↑+2H2O(2分,合理答案給分)
(2)防止G中水蒸氣進入U型管(1分)
(3)2NOCl+H2O=N2O3+2HCl(或2NOCl+H2O=NO↑+NO2↑+2HCl)(2分)
(4)防止NO被裝置中的氧氣氧化為NO2;保持Cl2過量,使NO完全轉(zhuǎn)化,避免
NO逸出污染空氣(2分)
五、(共14分)
24.(14分)
(1)C2H6O2 (2分) 乙二醇(1分) (2)ac(2分)
第一學期期末檢測高三化學.files/image041.jpg) (3)CH3CH(OH)COOH CH2=CHCOOH+H2O(2分)
消去(1分)
(3)CH3CH(OH)COOH CH2=CHCOOH+H2O(2分)
消去(1分)
(4)CH2=CHCH2COOH(2分) CH3CH=CHCOOH(2分)
(5)第一學期期末檢測高三化學.files/image043.jpg)
六、(共12分)
25.(12分)
(1)acd(2分) (2)HOCN(2分)
(3)第一學期期末檢測高三化學.files/image045.jpg) (2分)
8HNCO+6NO2=7N2+8CO2+4H2O(2分)
(2分)
8HNCO+6NO2=7N2+8CO2+4H2O(2分)
(4)NH4++OH-第一學期期末檢測高三化學.files/image039.jpg) NH3↑+H2O(2分) 2.8%(2分)
NH3↑+H2O(2分) 2.8%(2分)
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com