
第五單元 化學方程式
課題1 質量守恒定律
教學目標:
1、 識記:質量守衡定律
2、 理解:從微觀角度認識質量守衡定律
3:能用微粒的觀點說明質量守恒的本質原因,能用質量守恒定律解釋常見化學反應中質量關系。認識定量研究對化學科學發展的意義。
4:通過具體化學反應分析,使學生理解化學方程式的涵義。
重點:質量守恒定律的涵義及應用,正確書寫化學方程式。
難點:質量守恒定律的理解及應用,正確書寫化學方程式。
教學過程:
本單元內容分為兩部分,第一部分“質量守恒定律”從量的方面去研究化學反應的客觀規律,為化學方程式的教學作好理論準備,這是學好本單元內容的基礎。第二部分“化學方程式”講了書寫化學方程式的原則、方法和步驟,說明化學方程式表示的意義,這是本單元的中心。
一:質量守定律
展示化學反應實例為學生創設情境。引出化學反應前后物質的質量總和有何變化。
教師引導學生回答怎樣設計實驗來檢驗自己的猜想。
教師演示實驗:白磷燃燒設疑:(1)觀察到哪些現象?
(2)分析結果思考:反應中玻璃管上端沒有系小氣球,將會出現什么結果?
指導學生動手實驗,并設疑:反應前后物質總質量有何關系?通過實驗分析得出結論。(1)觀察到哪些現象?
(2)記錄反應前后物質總質量;
(3)分析結果。指導學生分析討論:以碳在氧氣中燃燒生成二氧化碳為例,從化學反應中分子、原子的變化情況說明化學反應必定符合質量守恒定律。教師通過微觀模擬講解化學反應前后原子的種類、數目、都沒有變化。
分組學生實驗:
1、鐵釘與硫酸銅溶液反應;
2、蠟燭燃燒
根據實驗結果分析化學反應前后物質的質量總和相等
講解化學方程式的書寫方法及化學議程式所表明的涵義指導學生討論:下列反應的化學方程式能提供給你哪些信
根據實驗結果分析化學反應前后物質的質量總和相等
實驗方案
實驗方案1
實驗方案2
實驗
反應前總質量
反應后總質量
分析
學生討論得出結論:化學反應前后原子的種類沒有改變,數目沒有增減,質量也沒有改變。
教材在從實驗的結果歸納出質量守恒定律后,接著就提出“為什么物質在發生化學反應前后,各物質的質量總和相等呢?”提出這個問題的目的,在于要引導學生從化學反應的實質上去認識質量守恒定律。在化學反應中,只是由于發生了原子間的重新組合,才使反應物變成生成物,但在這一變化中,原子的種類和個數并沒有發生變化,原子的質量也沒有發生變化,所以,反應前和反應后各物質的質量總和必然相等。應該注意,對質量守恒定律的本質分析,要明確落到化學反應前后原子的種類和個數保持不變這一關鍵點上,這不僅有利于理解質量守恒定律的本質,而且為學習化學方程式準備了基礎知識
【小結板書】參加化學反應的各物質的質量總和等于反應后生成的各物質的質量總和,這個規律叫做質量守恒定律。(此定律為重要概念可讓學生在1~2min內熟練背誦下來。)
〔設疑〕為什么物質在發生化學反應前后質量總是相等呢?
〔閱讀〕見教材有關內容,學生閱讀討論后回答。
〔板書〕在一切化學反應中,反應前后原子的種類沒有改變,原子的數目沒有增減.原子的質量也沒有變比。所以,化學反應前后各物質的質量總和必然相等。
〔鞏固練習〕1.試解釋鎂條在空氣中燃燒后,固體的質量增加了。
2.蠟燭燃燒后質量是否變化?是否遵守質量守恒定律?
二:化學方程式
化學方程式是初中化學入門的三種重要化學用語,掌握了它們才有可能學好化學,其重要性可想而知。學生已經學習了元素符號、化學式、化學反應的實質,知道了一些化學反應和它們的文字表達式,結合剛學習了質量守恒定律,已經完全具備了學習化學方程式的基礎
教材根據質量守恒定律,導出了化學方程式的概念,即用物質的化學式表示化學反應的式子叫化學方程式。通過木炭在氧氣中燃燒這個實例,用簡煉的文字準確敘述了化學方程式的意義:(1)表示了化學反應物和生成物。(2)表明了該化學反應進行的條件。(3)表示了各物質之間的質量關系,即各物質之間的質量比。
【復習提問】1.什么是質量守恒定律?2.為什么在化學反應前后,各物質的質量總和必然是相等的呢?(用原子、分子的觀點說明。)
〔引言〕我們已經知道質量守恒定律,那么在化學上有沒有一種式子,既能表示出反應物和生成物是什么,又能反映出遵循質量守恒定律呢?回答是肯定的,這就是化學方程式。
板書〕化學方程式
化學方程式:用化學式來表示化學反應的式子。
例如:木炭在氧氣中充分燃燒的化學方程式為:C + O2
 CO2
CO2
12∶ 16×2 ∶ 12+16×2
(指出化學方程式質和量的意義。) 12 ∶ 32 ∶ 44
化學方程式能客觀地反映出化學反應中“質”和“量”的變化及關系。所以化學方程式的讀法不同于數學方程式。化學方程式中的“+”號應讀成“和”,不能讀成“加”;反應物和生成物中間的“==”號,應讀成“生成”,不能讀成“等于”。
H2 + CuO 加熱 Cu + H2O
Mg+CuO加熱MgO+Cu
化學方程式可讀出質的變化,也可讀出量的變化。每個方程式都有三種讀法
現以2H2O 2H2↑+O2↑為例說明。
2H2↑+O2↑為例說明。
(一)物質讀法
上式讀作“在通電的條件下,水分解生成氫氣和氧氣”,這種讀法說明了化學反應中物質的變化。
(二)粒子讀法
上式讀作“在通電條件下,每2個水分子分解生成2個氫分子和1個氧分子”。這種讀法揭示了化學反應中結構微粒的變化,并反映出微粒個數的比例關系。
(三)數量讀法
上式讀作“通電時,36份質量的水分解生成4份質量的氫氣和32份質量的氧氣”,這種讀法表明了化學反應中物質的數量關系。
化學方程式跟數學方程有何不同?
數學上的方程式,僅是表示等號兩邊的數目相等。等號兩邊各項可以移項或倒寫。而化學方程式可以:
(l)表示反應物是什么,生成物是什么。
(2)表示各種反應物的總質量等于各種生成物的總質量(質量守恒)。
(3)表示反應物與生成物的原子、分子個數比。
(4)表示反應物和生成物的質量比。 化學方程式是不能倒寫和移項的,如,不能將3Fe+2O2 Fe3O4寫成 Fe3O4
Fe3O4寫成 Fe3O4 3Fe+2O2,也不能寫成3Fe
3Fe+2O2,也不能寫成3Fe Fe3O4-2O2。
Fe3O4-2O2。
至于化學方程式中的“+”和“=”號雖與數學中的“+”和“=”號在形式上一樣,但其意義卻不相同。化學方程式中的“+”,在讀時不讀“加”而是讀“和”。化學方程式中的“等號”表示“生成”的意思,同時表明在化學反應前后有兩個不變:原子種類不變;每種原子的總個數也不變。“=”讀作“反應生成”而不能讀“等于”。
課題2 如何正確書寫化學方程式
教學目標:
1:理解化學方程式書寫原則
2:學會化學方程式的簡單配平
重點:重點是正確書寫化學方程式
難點:難點是化學方程式的配平方法
教學過程:
化學方程式的書寫是本單元的一個重點內容。在講解書寫化學方程式要遵守兩個原則時,教材強調指出:不能隨意臆造事實上不存在的物質和化學反應,不能任意編造物質的化學式。教材以磷在空氣中燃燒生成五氧化二磷的反應為例,說明書寫化學方程式的三個步驟:
(1)依據實驗事實,把反應物的化學式寫在左邊,生成物的化學式寫在右邊,反應物與生成物之間用一條短線相連
(2):根據質量守恒定律,在反應物、生成物的化學式前配上適當的系數,使式子左、右兩邊的每一種元素的原子總數相等,這個過程叫化學方程式的配平。
(3):要在化學方程式中注明反應發生的基本條件,用“↓”表示生成物中的沉淀,用“↑”表示生成物中的氣體。在上述三個步驟中,以化學方程式的配平最為關鍵,
教材始終以質量守恒定律作為理論指導,化學方程配平,就是要使完成的化學方程式符合質量守恒定律,而且在最后還要求教師組織學生討論“為什么說質量守恒定律是書寫化學方程式的理論基礎?”來加以強化。
此外,教材還介紹了用最小公倍數法配平化學方程式。最小公倍數法是一種比較簡單和常用的配平方法,應當在課堂上適當組織練習,使學生初步學會這種配平方法。本單元教材的特點是:通過對多種化學實驗的觀察和思考,得出質量守恒定律,再把質量守恒定律運用于化學反應,配平化學方程式,并初步涉及到定量研究化學反應的科學方法
以磷在空氣中燃燒生成五氧化二磷的反應為例,說明書寫化學方程式的具體步驟。
〔板書〕1.根據實驗事實寫出反應物及生成物的化學式 P+O2─P2O5
2.配平化學方程式 用最小公倍數法確定系數。(根據是質量守恒守律)。把短線改等號。
4P+5O2===2P2O5
3.注明反應發生的條件4P+5O2點燃2P2O5
(介紹“△”’“↑”“↓”等符號表示的意義,及“↑”“↓”符號的使用范圍)。
〔講解〕反應條件常見的有:點燃、加熱(△)、高溫、催化劑等。
“↑”“↓”號的使用范圍:在反應物中無氣態物質參加反應,如果生成物中有氣體,則在氣體物質的化學式右邊要注“↑”號;在溶液中進行的化學反應,反應物無難溶性物質參加反應,如果生成物中有固體難溶性物質生成,在固體物質的化學式右邊要注“↓”號。(強調要防止隨意亂標)
對初中化學實驗教科書所說的“如果生成物有沉淀或者氣體產生,一般應該用“↓”號或者“↑”號表示出來,”理解不深。教師在教學中應強調“生成物”三個字。例二說明學生對酸、堿、鹽的溶解性不熟悉,分不清哪些是易溶物質,哪些是難溶物質。教師應加強對酸、堿、鹽溶解性表的教學,編成“口訣”,使學生背熟記牢。例三、例四都存在著“↓”、“↑”號書寫不規范的問題,教師在教學中應嚴格要求學生規范化。
(1)
書寫一般的化學反應方程式,包括化合、分解、置換和復分解反應。如果反應物和生成物均為氣態物質,可不用“↑”號表示生成物。 〔板書〕例如:H2+Cl2 2HCl 2SO2+O2
2HCl 2SO2+O2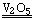 2SO3
2SO3
其中氯化氫和三氧化硫氣體可以不用“↑”表示。
(2)非水體系不用“↓”例:H2S=H2↑+S 2Cu(NO3)2 2CuO+4NO2↑+O2↑ 其中S和CuO不用“↓”號表示。
2CuO+4NO2↑+O2↑ 其中S和CuO不用“↓”號表示。
(一)要以事實為依據,不能臆造。例如有學生將鐵絲在氧氣里燃燒的化學方程式寫為:4Fe+3O2 2Fe2O3是錯誤的,因為他違背了鐵絲在氧氣里燃燒生成的是四氧化三鐵這一事實。
2Fe2O3是錯誤的,因為他違背了鐵絲在氧氣里燃燒生成的是四氧化三鐵這一事實。
(二)要分清反應物和生成物,不能將反應物和生成物“調位”。例如有學生將2H2+O2 H2O,寫成2H2O==2H2+O2是錯誤的,前者反應物是氫氣和氧氣,表示氫氣在氧氣里燃燃生成水的一個化合反應;后者反應物則是水,表示水在一定條件下反應生成氫氣和氧氣的一個分解反應,兩式所表示的意義是不同的。
H2O,寫成2H2O==2H2+O2是錯誤的,前者反應物是氫氣和氧氣,表示氫氣在氧氣里燃燃生成水的一個化合反應;后者反應物則是水,表示水在一定條件下反應生成氫氣和氧氣的一個分解反應,兩式所表示的意義是不同的。
(一)要遵循質量守恒定律,不能忘記配平。初學化學的人常易忘記配平,沒有配平就不能反映化學反應中“質量守恒”這一事實,不能稱為化學方程式。配平時,只能調整式子左右兩邊化學式前的系數,而不能改動化學式中元素符號右下角的小數字。如P2+5O=P2O5,2P+O5=P2O5等等都是錯誤的。
(四)要正確使用“↑“↓“Δ”等符號,不能忽視反應條件,許多化學反應在特定條件下才能進行,書寫化學方程式時,要在等號上標明反應條件,未標明反應條件的化學方程式不是一個完整的化學方程式。有的還應用“↑”“↓”來標明生成物的狀態,指生成了氣體、沉淀。如用氯酸鉀制取氧氣的化學方程式應寫成:2KClO3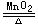 2KCl+3O2↑值得注意的是,只有當反應物為固態或液態物質、生成物中有氣態物質時,一般才可用“↑”標明。“Δ”符號表示加熱而不是點燃。
2KCl+3O2↑值得注意的是,只有當反應物為固態或液態物質、生成物中有氣態物質時,一般才可用“↑”標明。“Δ”符號表示加熱而不是點燃。
課題3 利用化學方程式的簡單計算
教學目標、1:使學生掌握利用化學方程式進行計算的步驟和方法。
2、通過化學議程式的計算提高學生分析問題、解決問題的能力。
3:在理解化學方程式的基礎上,使學生掌握有關的反應物、生成物的計算能力:掌握解題格式和鑰匙方法,培養學生鑰匙能力。思想教育:從定量的角度理解化學反應,了解根據化 學方程式的計算在工、農業生產和科學實驗中的意義,學會科學地利用能源。
重點:1:由一種反應物(或生成物)的質量求生成物(或反應物)的質量
2:利用化學方程式計算的步驟。
難點:1:根據化學方程式進行計算的方法。
2:物質之間量的關系。
教學過程:
完成下列各化學反應方程式,并求出有關物質之間的質量比。
1過氧化氫與二氧化錳混合,寫出反應物及生成物之間的質量比。
2碳在氧氣中燃燒,碳與氧氣的質量比。
3氫氣還原氧化銅,氧化銅與水的質量比。
4鋅與鹽酸反應,氯化鋅與氫氣的質量比。
二、 導入新課:
由于化學方程式反映出各物質的質量比,因此,我們可以根據化學方程式進行有關計算。進行計算時必須知道一種物質的質量,由此可以求出其它物質的質量。那么,怎樣根據化學方程式計算呢?
1:分組加熱3g和6g的高錳酸鉀,測出生成氧氣的質量,找出高錳酸鉀與氧氣之間的關系。
若制取氧氣袋中的氧氣質量是20克,讓學生計算需要高錳酸鉀的質量。
思考)例題1中所發生的反應的化學方程式怎么寫?
本題中已知質量的物質是誰?待求質量的物質是誰?
三、 新授部分:利用化學方程式的簡單計算
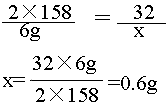 解](1)設未知量 設:加熱分解6g高錳酸鉀可以得到氧氣的質量為x。
解](1)設未知量 設:加熱分解6g高錳酸鉀可以得到氧氣的質量為x。
(2)寫出反應的化學方程式并配平2KMnO4 加熱 K2MnO4 + MnO2
+ O2↑
(3)寫出相關物質的相對分子的 2X158 ??? 32
質量和已知量、未知量 6g
??? x
4)列出比例式,求解
????????????????
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com