
【題目】我國宋代沈括在《夢溪筆談》中記載:信州鉛山縣有苦泉,流以為澗。挹其水熬之,則成膽礬。熬膽礬鐵釜,久之亦化為銅”。某化學興趣小組為探究膽礬(![]() )的熱分解產物,設計如圖所示裝置進行實驗:
)的熱分解產物,設計如圖所示裝置進行實驗:

已知:![]() 的熔點為16.8℃,沸點為46.8℃;
的熔點為16.8℃,沸點為46.8℃;![]() 的熔點為-72℃,沸點為-10℃.
的熔點為-72℃,沸點為-10℃.
請回答下列問題:
(1)儀器a的名稱是____,a中的棒香能復燃,說明熱分解產物含有_____(填化學式)。
(2)A中固體由藍色變為黑色,B中的現象是____。
(3)C中冰水的作用是_____。
(4)D中品紅溶液褪色,E中有![]() 、
、![]() 生成,寫出E中生成
生成,寫出E中生成![]() 的總的離子方程式:____。
的總的離子方程式:____。
(5)若生成![]() 和
和![]() 的物質的量之比為1:1,則膽礬熱分解的化學方程式為_____。
的物質的量之比為1:1,則膽礬熱分解的化學方程式為_____。
(6)小組同學用滴定法測定某膽礬樣品中![]() 的含量,取mg樣品配成100mL溶液,每次取20.00mL,消除干擾離子后,用0.1000mol/L的EDTA(
的含量,取mg樣品配成100mL溶液,每次取20.00mL,消除干擾離子后,用0.1000mol/L的EDTA(![]() )標準溶液滴定至終點,平均消耗EDTA溶液VmL(滴定反應:
)標準溶液滴定至終點,平均消耗EDTA溶液VmL(滴定反應:![]() )。
)。
①樣品中![]() 的質量分數為____%(用含m、V的代數式表示)。
的質量分數為____%(用含m、V的代數式表示)。
②下列操作會導致![]() 含量的測定結果偏高的是____(填選項字母)。
含量的測定結果偏高的是____(填選項字母)。
a.未潤洗錐形瓶
b.滴定終點時仰視讀數
c.滴定終點時滴定管尖嘴中有氣泡
【答案】(球形)干燥管 ![]() 固體由白色變為藍色 防止
固體由白色變為藍色 防止![]() 揮發(其他合理答案也給分)
揮發(其他合理答案也給分) ![]()
![]()
![]() b
b
【解析】
該題圍繞硫酸銅受熱分解產物的成分開展實驗探究。從實驗現象B中的白色![]() 粉末變為藍色,品紅溶液褪色,棒香能復燃等現象可推測出硫酸銅受熱分解會產生水蒸氣、
粉末變為藍色,品紅溶液褪色,棒香能復燃等現象可推測出硫酸銅受熱分解會產生水蒸氣、![]() 、
、![]() 。利用題目所給信息,反應生成
。利用題目所給信息,反應生成![]() 和
和![]() 的物質的量之比為1:1,則膽礬熱分解的化學方程式為
的物質的量之比為1:1,則膽礬熱分解的化學方程式為![]() ,以此作答。
,以此作答。
(1).儀器a的名稱是球形干燥管,也可稱為干燥管;在a中,棒香能復燃,說明反應中產生了助燃性的氣體氧氣,故答案應為(球形)干燥管、![]() ;
;
(2). A中固體由藍色變為黑色,說明膽礬發生了分解,產生了![]() 和水等。故B中的白色
和水等。故B中的白色![]() 粉末因吸水變為藍色,故答案應為固體由白色變為藍色;
粉末因吸水變為藍色,故答案應為固體由白色變為藍色;
(3). 由題目所給信息可知,![]() 的熔點為16.8℃,沸點為46.8℃,所以C中冰水的作用是為了使
的熔點為16.8℃,沸點為46.8℃,所以C中冰水的作用是為了使![]() 凝結,防止其揮發,影響對
凝結,防止其揮發,影響對![]() 的檢驗,故答案應為防止
的檢驗,故答案應為防止![]() 揮發;
揮發;
(4). D中品紅溶液褪色,證明氣體中存![]() ,故在E中為NaOH與
,故在E中為NaOH與![]() 反應生成
反應生成![]() ,后
,后![]() 被氧氣氧化為
被氧氣氧化為![]() ,該反應總的離子方程式為:
,該反應總的離子方程式為:![]() ,故答案應為
,故答案應為![]() ;
;
(5). 在反應中當生成1mol![]() 時轉移2mol電子,則應有0.5mol
時轉移2mol電子,則應有0.5mol![]() 生成,根據題目中生成
生成,根據題目中生成![]() 和
和![]() 的物質的量之比為1:1,則膽礬熱分解的化學方程式為
的物質的量之比為1:1,則膽礬熱分解的化學方程式為![]() ,故答案應為
,故答案應為![]() ;
;
(6). ①設膽礬樣品中![]() 的質量為x克,所以所取待測液中含有的銅離子的物質的量可表示為
的質量為x克,所以所取待測液中含有的銅離子的物質的量可表示為![]() 。由滴定反應原理,可建立如下關系:
。由滴定反應原理,可建立如下關系:
![]()
![]()
![]()
列算式:![]() =
=![]() ,x=0.08V g;則樣品中
,x=0.08V g;則樣品中![]() 的質量分數為
的質量分數為![]() %;
%;
② a.由于待測液中溶質的量由滴定管控制,故未潤洗錐形瓶,對滴定實驗結果不產生影響;
b.滴定終點時仰視讀數,則使讀得標準液的消耗體積偏大,由![]() 可知滴定結果偏高;
可知滴定結果偏高;
c.滴定終點時滴定管尖嘴中有氣泡,則使讀得標準液的消耗體積比實際消耗的偏小,由![]() 可知滴定結果偏低;
可知滴定結果偏低;
所以導致![]() 含量的測定結果偏高的是b。
含量的測定結果偏高的是b。


科目:高中化學 來源: 題型:
【題目】改變0.1mol/L的二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物質的量分數δ(X)隨pH的變化如圖所示![]() 。下列敘述正確的是
。下列敘述正確的是

A. Ka2(H2A)的數量級為10- 4
B. 0.1mol/L的NaHA溶液,pH=2.7
C. 向pH=0.5的溶液中逐滴加入強堿至pH=2.7的過程中,每滴一滴強堿,在X點時溶液pH變化最大
D. 0.1mol/LNa2A溶液的pH=8.6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知G、Q、X、Y、Z均為含氯元素的化合物,我們不了解它們的化學式,但它們在一定條件下有下列轉化關系(未配平,且四個反應均為氧化還原反應):
①G→Q+NaCl ②Q+H2O![]() X+H2↑ ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
X+H2↑ ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
這五種化合物中Cl元素化合價由低到高的順序是( )
A. G、Y、Q、Z、XB. X、Z、Q、G、Y
C. X、Z、Q、Y、GD. G、Q、Y、Z、X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是
A. 將飽和FeCl3溶液滴入沸水中制備膠體:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 用FeS去除廢水中的Hg2+:Hg2+ + S2- === HgS↓
C. AlCl3溶液與Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓
D. NH4Cl溶于D2O中顯酸性:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、W的原子序數依次增大,Z與W同周期且相鄰,W原子的最外層電子數與最內層電子數相等;X、Y的單質是空氣中的主要成分,在放電或高溫作用下化合成無色氣體。下列說法正確的是
A. X和Y的單質均不存在同素異形體
B. 簡單離子半徑:W>X>Z>Y
C. 化合物![]() 溶于水生成堿性氣體
溶于水生成堿性氣體
D. 工業上常用電解熔融W的氧化物的方法制備W的單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,兩種碳酸鹽MCO3(M分別為A和B兩種離子)的沉淀溶解平衡曲線如圖所示。已知:pM=lgc(M),p(CO32)=lgc(CO32)。已知ACO3比BCO3溶解度更大。(不考慮陰陽離子的水解)。下列說法正確的是

A. 線a表示ACO3的溶解平衡曲線
B. 該溫度下,向ACO3的飽和溶液中加入Na2CO3溶液,一定能產生沉淀
C. 向0.1L 1mol/L的BCl2溶液中加入Na2CO3固體,當加入Na2CO3固體的質量為116.6g時,B2+離子恰好沉淀完全(B2+離子為10—5mol/L時認為沉淀完全)
D. ACO3的Ksp=10—4.4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據原電池原理,回答下列問題:

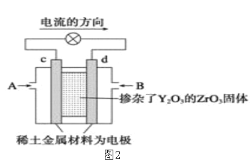
(1)圖1是依據氧化還原反應:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)設計的原電池裝置。
①電極X的材料是________(填化學名稱);電極Y的材料是__________(填化學名稱)。
②Y電極發生的電極反應式為:______________。
(2)圖2是使用固體電解質的燃料電池,裝置中,以稀土金屬材料作惰性電極,在兩極上分別通入CH4和空氣,其中固體電解質是摻雜了Y2O3的ZrO2固體,它在高溫下能傳導正極生成的O2-離子(O2+4e―→2O2-)。
①c電極為______________極。(填“正”或“負”)
②d電極上的電極反應式為___________________________。
③如果消耗甲烷160g,假設化學能完全轉化為電能,則轉移電子的數目為______________(用NA表示),需要消耗標準狀況下氧氣的體積為_______L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固體,HS-濃度減小。下列說法正確的是
HS-+OH,在溶液中加入少量CuSO4固體,HS-濃度減小。下列說法正確的是
A. 稀釋溶液,水解平衡常數增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高溫度![]() 增大
增大
D. 加入MgCl2固體,HS-濃度減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,甲、乙兩池電極材料都是鐵棒和碳棒,請回答下列問題:

(1)若兩池中電解質溶液均為CuSO4溶液,則反應一段時間后:
①有紅色物質析出的是甲池中的________棒,乙池中的________棒。
②乙池中陽極的電極反應式是__________________________________。
(2)若兩池中電解質溶液均為飽和NaCl溶液:
①寫出乙池中總反應的離子方程式_______________________________。
②甲池中碳極上電極反應式是____________________________,乙池碳極上電極反應屬于______________(填“氧化反應”或“還原反應”)。
③將濕潤的KI淀粉試紙放在乙池碳極附近,發現試紙變藍,反應的化學方程式為________________________________________。
④若乙池轉移0.02 mol e-后停止實驗,池中電解質溶液體積是200 mL,則溶液混合均勻后的c(OH—)=________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com