
【題目】醋酸的電離方程式為CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃時,0.1mol/L醋酸溶液中存在下述關系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的數值是該溫度下醋酸的電離平衡常數(Ka)。下列說法正確的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃時,0.1mol/L醋酸溶液中存在下述關系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的數值是該溫度下醋酸的電離平衡常數(Ka)。下列說法正確的是
A. 向該溶液中滴加幾滴濃鹽酸,平衡逆向移動,c(H+)減小
B. 向該溶液中加少量CH3COONa固體,平衡正向移動
C. 該溫度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高溫度,c(H+)增大,Ka變大
科目:高中化學 來源: 題型:
【題目】明礬石是制取鉀肥和氫氧化鋁的重要原料,明礬石的組成和明礬相似,此外還含有氧化鋁和少量氧化鐵雜質。具體實驗步驟如下圖所示(明礬石焙燒后成分不變):
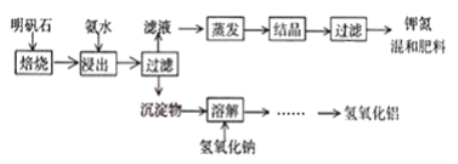
完成下列填空:
(1)“浸出”反應的離子方程式為_______。“浸出”所用稀氨水濃度為39.20g/L,配制500mL該氨水需251.28g/L的濃氨水________mL。
(2)“過濾”所需的玻璃儀器有______________。
(3)寫出“溶解”過程中發生反應的化學方程式_________、________。
(4)檢驗濾液中是否含有SO42-的實驗方法__________。
(5)為測定鉀氨復合肥K2SO4、(NH4)2SO4中SO42-的質量分數,設計實驗步驟如下:
①_____________________。
②溶于水,加入足量BaCl2溶液,待白色沉淀不再產生為止。
③過濾、______、________(依次填寫實驗操作名稱)。
④冷卻、稱量所得沉淀的質量。
(6)若所取試樣和所得沉淀的質量分別為mg、ng,試用含有m、n的代數式表示該鉀氮復合肥中SO42-的質量分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于以下物質熔點比較正確的是( )
A.NaCl>金剛石>S>Hg
B.金剛石>NaCl>S>Hg
C.NaCl>金剛石>Hg>S
D.金剛石>NaCl>Hg>S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用石墨作電極,電解盛放在U形管中的飽和NaCl溶液(滴有酚酞溶液),如圖。下列敘述正確的是
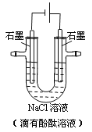
A. 通電后,NaCl發生電離
B. 通電一段時間后,陽極附近溶液先變紅
C. 當陽極生成0.1 mol氣體時,整個電路中轉移了0.1 mol e-
D. 電解飽和食鹽水的總反應式為:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用如下裝置(略去部分夾持裝置)模擬利用氨氣和次氯酸鈉合成肼(N2H4)的過程。下列說法正確的是( )
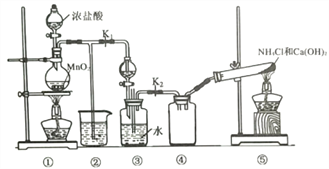
A. 將裝置① 中濃鹽酸換成H2O2,也可用于制備氧氣 B. ②中盛裝NaOH溶液,用于吸收多余的Cl2
C. ③分液漏斗中盛裝飽和食鹽水 D. 當反應結束時,④中可收集一瓶純凈的NH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是一種高效漂白劑,某小組利用下列裝置制備NaClO2,并對其樣品進行分析,查閱資料知:NaClO2飽和溶液在低于38℃時析出NaClO2·3H2O,高于38℃時析出NaClO2,高于60℃時析出NaClO2會分解。
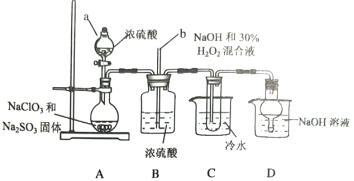
(1)儀器a的名稱是__________;長玻璃導管b的作用是__________;裝置D的作用是__________。
(2)裝置A用于制備ClO2,理論上所加NaClO3和Na2SO3固體的物質的量之比是__________。
裝置C中發生的離子方程式是__________。
(3)為提取NaClO2固體,試管中產品需蒸發結晶、過濾、洗滌,洗滌用水的溫度范圍是__________。
(4)稱取Wg的產品配成250mL溶液,取25.00mL溶液,加足量KI和稀H2SO4,以①__________溶液作指示劑,用cmol·L-1Na2S2O3標準液滴定至終點(I2+2S2O32-=2I-+S4O62-),判斷滴定終點的現象是②_________;若消耗標準溶液體積的平均值是VmL,則產品中NaClO2的質量分數是③__________%。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在銅鋅原電池中,鋅電極上發生的反應為Zn-2e-=Zn2+,則( )
A. 鋅電極為負極 B. 鋅電極為正極
C. 電子從銅電極流向鋅電極 D. 反應中Zn被還原
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com